简介
由于成熟miRNA的长度仅为约22nt,无法进行PCR扩增反应.所以在进行该法检测之前,要对所提取的miRNA进行结构上的处理。一般的做法是在成熟miRNA的一端连接上一段已知序列的核苷酸,经反转录后,再以此为模板进行后续的PCR扩增。目前常用的是茎环法和加尾法。
原理
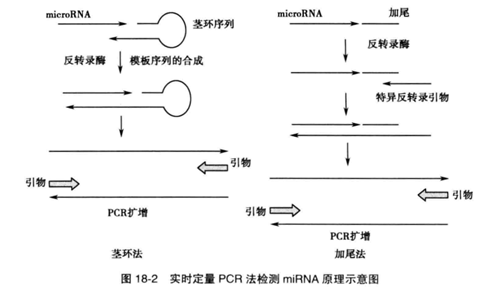
实时定量PCR测定组织和细胞内miRNA丰度中茎环法的基本原理是在miRNA成熟序列的3'-端加上一段茎环序列,茎环尾部的6-7个碱基能够与miRNA的末端互补结合(图18-2),为模板序列的合成提供羟基。在反转录酶存在的情况下,以miRNA的成熟序列为模板进行反转录,形成一段包含miRNA及茎环结构的序列。这增加了miRNA的核苷酸序列,使PCR扩增成为可能。加尾法在定量PCR前,先在成熟miRNA的3'-端加上一段多聚A尾,并用5'-端带有40nt错定序列的Oligo(dT)引物进行反转录,使得样品中所有的miRNA均被延伸(图18-2)。
用途
实时定量PCR技术已经被广泛应用于基础科学研究、临床诊断、疾病研究及药物研发等领域。
材料与仪器
步骤
实时定量PCR的基本过程可分为如下几步:
(一)引物和探针的设计
检查比对序列,先选择好探针的位置,然后设计引物使其尽可能地靠近探针。
探针的设计原则是:
①尽可能短,不要超过30 bp;;②Tm值应在68-70 ℃之间;③避免5'-端是鸟苷酸(G),以免发生淬灭作用;④选择胞苷酸(C)多于鸟苷酸(G)的链作探针,G的含量多于C会降低反应效率。
(二)动物组织/细胞总RNA的抽提及检测(TRIzol法)
A. 取新鲜动物组织0.1~0.2 g置于研钵中,用剪刀剪碎组织,研钵中加入少量液氮,迅速研磨,待组织变软,再加少量液氮,再研磨,成粉末状,每100 mg组织加入1 ml TRIzol,在冰浴中迅速匀浆15~30 s,以充分研碎组织。然后将细胞悬浮液吸入另一微量离心管中,室温下静置5 min。
B. 若为贴壁细胞,培养预定时间后,彻底弃掉培养液。将TRIzol试剂直接加在贴壁细胞上,室温放置10 min;若为悬浮培养细胞,则直接离心收集细胞后用TRIzol重悬、裂解,每1 ml TRlzol可裂解5x106个动物、植物或酵母细胞,或1X107个细菌菌体。
C. 反复吹打裂解组织/细胞,裂解液移入新管,室温静置5 min,4 ℃、12000 g离心10 min。
D. 将上清转移入新管,按照TRIzol:氯仿等于5:1的比例加入氯仿200 µl,用力颠倒充分混匀,静置10 min,待其分层后,4 °C、12000 g离心15 min。
E小心转移水相至新管中,加入等体积异丙醇,振荡混匀,室温放置10 min,4 ℃、12000 g离心10 min,小心弃上清。
注意事项:
RT-PCR实验的成败在很大程度上取决于RNA的纯度和完整性。利用动物组织/细胞提取RNA时,要利用高浓度的蛋白质变性剂以及酚、氯仿等有机溶剂处理、离心,使RNA与其他细胞组分分离。
在提取的过程中要抑制内源和外源的RNA酶(RNase)活性,保护RNA分子不被降解。因此提取必须在无RNase的环境中进行,配制RNA提取试剂要用焦碳酸二乙酯(diethypyrocarbonate,DEPC)处理过的水以去除残余的RNA酶。
(三)茎环法RT-PCR反应
A. 反转录
在微量离心管中加入模板RNA 2 µg,Oligo(dT)18(0.1 µg/µl)5 µl,10 mmol/L dNTP 2 µl,DEPC水补足体积至14 µI,65 °C水浴5 min,立即放到冰上,顺序依次加入:
37 ℃孵育60 min。
B. PCR反应
DEPC水 37.5 µI
扩增程序:
94 ℃ 5 min热启动;94 °C 45 s,57 ℃ 30 s,72 ℃ 1 min,30个循环;72 °C 10 min。
注意事项:
RT-PCR中的关键步骤是RNA的反转录,然后核糖核酸酶H(RNaseH)催化DNA-RNA杂合体的RNA部分降解。未除净的蛋白质可与RNA结合从而影响反转录和PCR反应。若RNA模板中污染了微量DNA,扩增后会出现非特异DNA的PCR产物。
(四)加尾法RT-PCR反应
A. 加尾反应。冰上配制以下体系:
B. 轻弹混匀反应混合物,短暂离心后置于37 ℃反应30 min,并于95 ℃反应5 min灭活酶,所得产物可立即进行cDNA第一链合成,也可于-20 ℃保存。
C. 将10 µl(1 µg)polyA加尾处理后的RNA加入无RNA酶的微量离心管中,并于65 ℃温育5 min,反应完毕立即置于冰上。
D按下表顺序配制反转录反应体系:
E. RT反应:轻弹混匀反应混合物,短暂离心后置于42 ℃反应1 h,反应结束后于95 ℃加热5 min终止反应,获得的cDNA 稀释后可直接用于而RNA的检测。
(五)PCR数据分析
一般而言,荧光扩增曲线可以分成3个阶段:荧光背景信号阶段、荧光信号指数扩增阶段和平台期,其形状是一条平滑的"S"形曲线。
1. 标准曲线法的绝对定量 用一系列已知浓度的标准品制作标准曲线。标准品可以是纯化的质粒DNA,体外转录的RNA,或者是体外合成的单链DNA。
2. 标准曲线法的相对定量 属于自身相对标准曲线。所用的标准品只要知道其相对稀释度即可。在整个实验中样品靶序列的量来自于自身标准曲线,最终必须除以参照物的量。
3. Ct比较法的相对定量运用数学公式[ΔΔCt=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照]来计算相对量,Ct是热循环仪检测到达设定的阈值荧光信号时所经历的循环数。
假设每个循环增加1倍的产物数量,在PCR反应的指数期得到的Ct值反映起始模板的量,一个循环的不同相当于起始模板数2倍的差异(2-ΔΔCt)。所以,2-ΔΔCt表示的是实验组目的基因的表达相对于对照组的变化倍数。该方法不必制作标准曲线,但前提是目的基因与内参基因要有类似的扩增效率。
常见问题
常见问题 1
问题表现:影响特异性的因素
常见问题 2
问题表现:影响重复性的因素
常见问题 3
问题表现:标准曲线的线性关系不佳
解决方案 1:减小加样误差。
解决方案 2:妥善保存标准品,防止降解。
常见问题 4
问题表现:影响敏感度高低的因素
解决方案 1: 用TaqMan探针代替SYBR Green。
解决方案 3: 要尽可能地优化引物设计。使两条引物的GC含量大致一致,使用纯化的引物进行实验等都有助于防止引物二聚体形成。
来源:丁香实验