简介
原理
Northern印迹测定组织和细胞内miRNA丰度的基本原理是通过凝胶电泳使完全变性的RNA按大小分离,然后利用印迹技术将RNA分子转移到固相支持物上,固定后再采用特异性的探针进行杂交来鉴定其中特定mRNA分子的量与大小。
用途
材料与仪器
步骤
Northern印迹测定组织和细胞内miRNA丰度的基本过程可分为如下几步:
(一)制备凝胶
(二)样品处理
(三)RNA电泳
在加样孔中依次加入足量的RNA样品和分子量标记物(marker),采用5 V/cm(电极长度)电压降进行电泳,当溴酚蓝指示剂迁移到凝胶前沿时停止电泳。
印迹转移前切下含分子量标记物泳道的凝胶,EB染色后,于紫外灯下放一根尺子拍照,记下分子量标记的片段位置,以便杂交后确定杂交带的分子量大小。在真核细胞中富含两种RNA,即28S rRNA(4718nt)和18S rRNA(1874nt),它们不仅可以用作分子量的标记,同时也是RNA是否发生降解的一个指标。
注意事项:
质量较好的RNA样品在变性琼脂糖凝胶中,于紫外灯下观察应该清晰可见,而且28S rRNA的含量应该明显高于18S rRNA(通常约为2倍)。
(四)RNA转移
根据实验条件,选用合适的转移方法,下面将以毛细管转移法为例介绍具体操作步骤。将一塑料或玻璃平台放在盛有足量的20xSSC的托盘内,剪2张适当大小的Whatman 3MM滤纸在缓冲液中浸润后铺在平台上,滤纸的两端要完全浸没在溶液中,并注意排除滤纸与转移平台之间的气泡。
然后将用20xSSC浸泡后的凝胶以加样孔面朝下平放在滤纸上,用封口膜将凝胶的四周围住,再将预先依次经去离子水、20xSSC溶液浸湿(至少5分钟)的与凝胶大小一致的硝酸纤维素膜(或尼龙膜)平整地铺在凝胶上(见图6-4)。
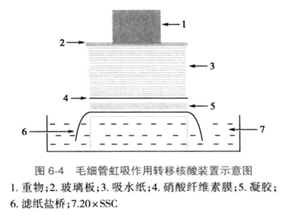
取2张Whatman 3MM滤纸(与杂交膜一样大小)在转移缓冲液中浸湿后,依次铺于杂交膜上,排除两者之间的气泡。再于滤纸上压足够量的与其大小相同的吸水纸,最后在上面放一个平板,上压约500 g重物,室温转移8-12小时后,撤除转移装置,取出杂交膜。
注意事项:
RNA由凝胶中转移到固相支持物上前,含甲醛的凝胶必须用经DEPC处理的水淋洗数次,以除去甲醛。如果琼脂糖浓度大于1% 或疑胶厚度大于0.5 cm或待测RNA大于2500 nt,需用0.05 mol/L NaOH浸泡凝胶20分钟(部分降解RNA,以提高其转移效率),浸泡后用DEPC处理过的水淋洗,并用20xSSC浸泡凝胶45分钟,然后进行转移。
(四)膜上RNA分子的固定
为了满足后续杂交实验的要求,必须将转移后的RNA固定到杂交膜上。将晾干的硝酸纤维素膜或尼龙膜放在两张3MM滤纸中间,80 °C干烤2小时。
对于尼龙膜,可以采用紫外交联仪(254 nm波长的紫外线)照射尼龙膜上结合有核酸的一面,使尼龙膜与核酸分子之间形成共价结合。对于湿润的尼龙膜总照射剂量参考值为1.5 J/cm2,干燥的尼龙膜约为0.15 J/cm2,建议进行预实验以大致确定杂交信号最强时的照射剂量。
(五)膜的杂交
用标记的核酸探针与转移到固相支持物上的核酸片段进行杂交。杂交溶液中加有已标记和变性的单链核酸或寡核苷酸探针,在一定条件下与印迹转移后固定在固体支待物上的互补核酸单链退火形成双链杂交体。
杂交前首先进行预杂交,目的是将杂交膜上的非特异性RNA结合位点封闭,减少与探针的非特异性吸附作用,降低杂交结果的本底。配制实验所需的适量预杂交液:6xSSC,5xDenhardt试剂,0.5% SDS及100 µg/ml经变性的鲑精DNA(salmon sperm DNA,ssDNA);或者6xSSPE,5xDenhardt试剂,0.5% SDS,100 µg/ml经变性的鲑精DNA及50% 甲酰胺。
应用前者时预杂交温度为65 °C,应用后者时预杂交温度为42 °C。这两种预杂交液对杂交膜的封闭效果没有明显的差异,可以依实验条件的不同任选一种。
预杂交液中的多种大分子物质如ssDNA、牛血清白蛋白等与杂交膜表面及待测核酸分子中的非特异性大分子结合位点以疏水作用力或其他次级键的形式结合,从而封闭这些非特异性结合位点。
将固定后的杂交膜在2xSSC中浸湿后,放入含适量预杂交液的杂交筒(或高质量的塑料袋)内,盖紧杂交筒盖后,置于杂交仪内滚动,选择合适的温度预杂交1-2小时。
将杂交筒内的预杂交液弃去,再加入适量的杂交液(在预杂交液中加入适量的杂交探针),再在同样的温度中进行杂交过夜(16小时以上)。如果标记的探针为双链,则杂交探针在加入到杂交液之前,于100 °C加热5分钟使其彻底变性,然后迅速置冰水浴中将探针骤冷。单链探针无需变性。
杂交完成后,必须通过洗膜过程将滤膜上未与RNA杂交的以及非特异性杂交的探针分子洗去。由于非特异性杂交的杂交体稳定性较低,在一定的温度和离子强度下,非特异性杂交体易发生解链而被洗掉,而特异性杂交体则保留在滤膜上。
(六)杂交结果的检测
(1)放射性核素标记探针的检测:洗膜结束后.取出杂交膜,用笔或针孔在滤膜的一定部位进行标记,以利于杂交结果的定位。将滤膜用保鲜膜包好,置暗盒中,将磷钨酸钙增感屏前屏置于滤膜下,光面向上。
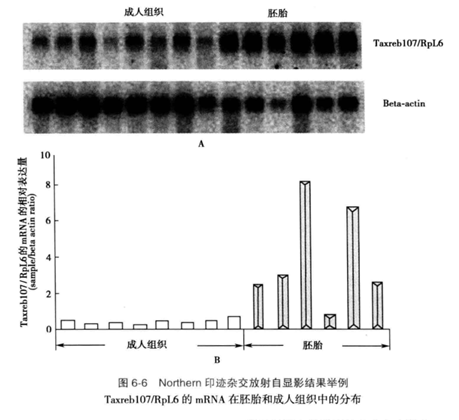
在暗室,将1-2张X线胶片压在杂交膜上,再压上增感屏后屏,光面向X线胶片。盖上暗盒,置-70 ℃曝光适当时间。根据放射性的强度曝光一定的时间后,在暗室中取出X线胶片,显影、定影。如果曝光不足,可再压片重新曝光。图6-6给出了一个典型的Northern印迹杂交结果。
(2)非放射性标记物探针的检测:以生物素标记的探针在杂交结束后,加入结合有HRP或AP的链亲和素或抗生物素蛋白,这些经过酶修饰的链亲和素或抗生物素蛋白可以与生物素发生特异性结合。
结合了AP的杂交膜再用硝基四氮唑蓝(nitroblue tetrazolium,NBT)和5-溴-4-氯-3-吲哚磷酸二钠盐(5-bromo-4-chloro-3-indolyl phosphate,BCIP)处理,在杂交探针存在的地方将形成不溶性的颜色化合物。
此外,也可以用化学发光过程代替这种颜色反应。AP可以分解化合物磷酸金刚烷基1,2-二氧杂环丁院(adamantyl 1,2-dioxetane phosphate,AMPPD),产生对标准X线胶片曝光的光,通过放射自显影得到更高的灵敏度,而且这种膜可以重复使用。
对于地高辛标记探针的检测,在杂交结束后加入结合有HRP或AP的抗地高辛单克隆抗体,它可以同地高辛特异性结合。
注意事项
1. 保持RNA的稳定。由于RNA非常不稳定,极易降解,因此首先要创造一个无RNA酶的环境。在杂交过程中RNA接触到的所有容器、试剂均要进行处理,猝灭其中的RNA酶。
整个操作过程应该与其他可能含RNA酶的操作分开,而且操作时最好戴上一次性手套和口罩,因为人体各种来源的污染物中含有丰富的RNA酶。
2. 如果没有杂交信号或信号弱,则需要从RNA样品的制备及转移、探针片段的选择及标记、杂交及洗膜的条件选择、标记物的示踪反应等方面进行综合性分析。
3. 除硝酸纤维素膜外,尼龙膜也基本适用于毛细管法的RNA转移。使用尼龙膜时,印迹前应用水将含甲醛凝胶中的甲醛冲洗掉。另外,尼龙膜可在碱性条件下与RNA结合,因此也可用7.5 mmol/L NaOH作为转移液。
碱性条件下RNA不可逆地与尼龙膜结合,因此,RNA转移到尼龙膜后不须经烘烤或用紫外线照射固定。碱性转移后,尼龙膜只需用2xSSC及0.1% SDS漂洗,然后置室温干燥即可。
来源:丁香实验







