抗体的纯化和鉴定实验
最新修订时间:
简介
作者:霍华德,本实验来自「抗体制备与使用实验指南」
来源:丁香实验
操作方法
通 过 沉 淀 进 行 部 分 纯 化 用硫酸铵沉淀蛋白质是抗体部分纯化中最古老的方法之一。将饱和硫酸铵加入血清或者腹水中来沉淀抗体。通过离心分离沉淀与未沉淀的蛋白质。当用水溶剂将沉淀重悬后 ,所得的溶液即为富含抗体的液体。 相比之下,使用辛酸沉淀,大多数沉淀的蛋白质不是免疫球蛋白。此操作结束后,抗体存在于上清中。 标准试剂的准备[如I X 磷酸盐缓冲液(PBS)]在本书其他章节已有介
蛋 白 质 A 和 蛋 白 质 G蛋 白 质 A 和 蛋 白 质 G 依我们的经验,蛋 白 质 A 和蛋白质G 为从血清、腹水、细胞培养上清中纯化单克隆抗体提供了最好的方法。纯化后的终产品纯度最低可达9 5 % ,可用于各种实验和操作。用蛋 白 质 A 或蛋白质G 进一步处理纯化的单克隆抗体所得到的抗体,可用来进行临床前期或临床试验。现在也有许多纯化仪器使这些操作自动化。 一、 蛋 白 质 A 蛋白质 A 是细菌细
I g G 抗 体 的 其 他 纯 化 方 法抗体纯化还有其他方法。最著名 的 是 分 子 筛 层 析 法(size exclusion chromatography, SEC)及离子交换层析法(ion exchange chromatography, IEC)。 对于 IEC , 有许多阴离子交换树脂,它们作用于单克隆抗体的效果要好于多克隆抗体,因为想要纯化出最局产量的抗体就需要知道抗体的等电点(isoelectric point, pi)
Ig M 和 Fab 抗体片段的纯化IgM 抗体以难于纯化著称,因为它是以五聚体结构存在。要 纯 化 IgM ,需要结合盐析 及 IEC 或 者 SEC 的多步操作,这 是 纯 化 IgM 的令人满意的手段,但是对于大量的抗体 ,这种方案过于繁琐且预期的产量低。在我们实验室,我们用两种其他的亲和柱纯化IgM- 蛋白质 L 亲和层析和山羊抗鼠 IgM 抗体亲和层析。 一、 抗 鼠 I g M 抗体亲和层析 我们实验室纯化
蛋 白 质 L 亲和层析蛋 白 质 L 亲和层析 蛋白 质 L 对 Ig s 的 X 轻链具有高亲和力,可纯化完整抗体和抗体的片段。因此,可用其 对 IgM 和 Fab 及 F(ab); 片段进行纯化。除了这些特性,我们还发现纯化结果不稳定,并且其半衰期短。但 是 ,蛋 白 质 L 是一种替代型「广谱」抗体纯化基质。蛋 白 质 L 与免疫球蛋白的 K 轻链结合,这对于纯化抗体片段及完整的 IgG、IgM 和 Ig
高效色谱法高效色谱法 如文献所述,采用基于非重力的色谱技术,如 HPLC,仅用一个小容积的柱子也可以纯化出纯度极高的抗体 [3]。尽管 未 在 本 实 验 室 操 作 ,这 种 技 术在下列情况下特别有 用 :分 离 和 鉴 定 小 量 蛋 白 质 样 本(如 活 检 组 织 )时 ,亲 和 结 合 能 力 必 须 被 测 定 并 用于治疗用途时;当 需 要 大 量 筛 选 样 本(如 筛 选 抗
抗体的鉴定抗体的鉴定 抗体可通过各种各样的物理化学方法及功能分析等进行鉴定,所使用的方法都是最标准的,并会提供抗体的独特性、完整性、纯度及功能等信息。这些方法包括: 醋酸纤维膜上的区带电泳、A28。浓度测定、SDS-PAGE、免疫印迹、等电聚焦及酶联免疫分析(酶免疫分析)。 一、区 带(醋 酸 纤 维)电泳 区带电泳是依据蛋白质的电荷特性将蛋白质彼此分开。我 们 用 Hel
通 过 280nm 吸光度测定抗体浓度通 过 280nm 吸光度测定抗体浓度 测定纯化的抗体浓度的最快捷的方法之一是测定其在 280nm(A280) 处的吸收。对于这个,需要一台紫外分光光度计来检测在紫外区内的光传递。那些含有芳香族氨基酸残基 (色氨酸、苯丙氨酸及酪氨酸)的蛋白质会在波长约为 280nm 处吸收光线能源。依据这三种氨基酸的已知数值,每种蛋白质都有其自己的消光系数。对于免疫球蛋白,其成分的差异在很大程度上可以被
免疫印迹免疫印迹 当知道蛋白质相对分子质量的大小,免疫印迹方法可从任何数量的蛋白质混合物中检测出目的蛋白。不过,这种方法要依赖使用针对目的蛋白的一种高质量的抗体。这是用 SDS-PAGE 方法对蛋白质按相对分子质量大小进行分离和直接酶免疫检测方法结合在一起检测方法。这种方法不仅能确定目的蛋白是否存在,也能确定其相对分子质量大小。 一、 试刻 转移缓冲液: 25mmol/L T ris ,
等电聚焦等电聚焦 等电聚焦是测定抗体等电点(P l)的一个非常有用的方法。知 道 抗 体 的 p i 将决定在用 IE C 对抗体纯化时的正确纯化条件以及决定抗体的最佳储存条件。这个结果如同特定的抗体「指纹」,因为抗体根据制备方法的不同可产生一系列等电点电泳条带。抗体的等电点「指纹」在一些条件下会发生明显改变,如保存的缓冲液会发生变化、抗体的脱芻;基 ,以及抗体是来自体内或者体外培养技术等。
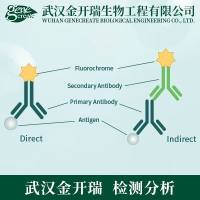
酶免疫分析酶免疫分析 酶免疫分析,如 E L IS A ,是免疫分析的主要部分。理解了 E L IS A 的实验原理,就可以 理 解 其 他 以 抗 原 -抗 体 反 应 为 基 础 的 实 验 原 理 。依 据 其 实 验 操 作 程 序 ,我们知道E U S A 方法能检测任何给定抗体的特异性、亲和 性 、浓度及灵敏性。下面是进行直接或间 接 E L IS A 的操作步骤。直接与间接 E L
相关产品推荐
相关问答