原理
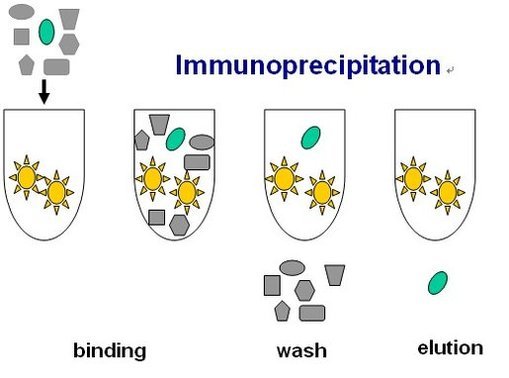
其原理是:当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。目前多用精制的prorein A预先结合固化在argarose的beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A就能吸附抗原达到精制的目的。这种方法常用于测定两种目标蛋白质是否在体内结合;也可用于确定一种特定蛋白质的新的作用搭档。
材料与仪器
步骤
一、试剂准备
1. 预冷PBS,RIPA Buffer,细胞刮子(用保鲜膜包好后,埋冰下),离心机。
2. 用预冷的PBS洗涤细胞两次,最后一次吸干PBS。
3. 加入预冷的RIPA Buffer(1 ml/107个细胞、10 cm培养皿或150 cm2培养瓶,0.5 ml/5x106个细胞、6 cm培养皿、75 cm2培养瓶)。
4. 用预冷的细胞刮子将细胞从培养皿或培养瓶上刮下,把悬液转到1.5EP管中,4℃,缓慢晃动15 min(EP管插冰上,置水平摇床上)。
5. 4℃,14000 g离心15 min,立即将上清转移到一个新的离心管中。
6. 准备Protein A agarose,用PBS 洗两遍珠子,然后用PBS配制成50%浓度,建议减掉枪尖部分,避免在涉及琼脂糖珠的操作中破坏琼脂糖珠。
7. 每1 ml总蛋白中加入100 ul Protein A琼脂糖珠(50%),4℃摇晃10 min(EP管插冰上,置水平摇床上),以去除非特异性杂蛋白,降低背景。
8. 4℃,14000 g离心1 5min,将上清转移到一个新的离心管中,去除Protein A珠子。
9. (Bradford 法)做蛋白标准曲线,测定蛋白浓度,测前将总蛋白至少稀释1:10倍以上,以减少细胞裂解液中去垢剂的影响(定量,分装后,可以在-20℃保存一个月)。
10. 用PBS将总蛋白稀释到约1 ug/ul,以降低裂解液中去垢剂的浓度,如果兴趣蛋白在细胞中含量较低,则总蛋白浓度应该稍高(如10 ug/ul)。
11. 加入一定体积的兔抗到500 ul总蛋白中,抗体的稀释比例因兴趣蛋白在不同细胞系中的多少而异。
12. 4℃缓慢摇动抗原抗体混合物过夜或室温2h,激酶或磷酸酯酶活性分析建议用2 h室温孵育。
13. 加入100 ul Protein A琼脂糖珠来捕捉抗原抗体复合物,4℃缓慢摇动抗原抗体混合物过夜或室温1 h,如果所用抗体为鼠抗或鸡抗,建议加2 ul "过渡抗体"(兔抗鼠IgG,兔抗鸡IgG)。
14. 14000 rpm瞬时离心5 s,收集琼脂糖珠-抗原抗体复合物,去上清,用预冷的RIPA buffer洗3遍,800 ul/遍,RIPA buffer有时候会破坏琼脂糖珠-抗原抗体复合物内部的结合,可以使用PBS。
15. 用60 ul 2x上样缓冲液将琼脂糖珠-抗原抗体复合物悬起,轻轻混匀,缓冲液的量依据上样多少的需要而定(60 ul足够上三道)。
16. 将上样样品煮5 min,以游离抗原,抗体,珠子,离心,将上清电泳,收集剩余琼脂糖珠,上清也可以暂时冻-20℃,留待以后电泳,电泳前应再次煮5 min变性。
二、免疫共沉淀反应
2. 取少量裂解液以备Western blot分析,剩余裂解液加1ug相应的抗体加入到细胞裂解液,4°C缓慢摇晃孵育过夜;
3. 取10 ul protein A 琼脂糖珠,用适量裂解缓冲液洗3 次,每次3 000 rpm离心3 min;
4.. 将预处理过的10 ul protein A 琼脂糖珠加入到和抗体孵育过夜的细胞裂解液中4°C缓慢摇晃孵育2-4 h,使抗体与protein A琼脂糖珠偶连;
5. 免疫沉淀反应后,在4°C 以 3000 rpm 速度离心3 min,将琼脂糖珠离心至管底;将上清小心吸去,琼脂糖珠用1 ml裂解缓冲液洗3-4次;最后加入15 ul的2xSDS 上样缓冲液,沸水煮5分钟;
6. SDS-PAGE,Western blotting或质谱仪分析。
三、通过免疫共沉淀确定结合蛋白
1.用磷酸盐缓冲液洗30块10 cm培养板上的适宜细胞。刮去每块板上的细胞到1 ml冰冷的EBC裂解缓冲液中;
2.将每毫升细胞悬液转移到微量离心管中,在微量离心机上4℃以最大速度离心15 ;
3.收集上清(约30 ml)并加入30 ug的适当抗体,4℃摇动免疫沉淀物1 h;
4.加入0.9 ml的蛋白质A-Sepharose 悬液,4℃摇动免疫沉淀物30 min;
5.用含900 mmol/L NaCl的NETN洗蛋白A-Sepharose混合物,再重复洗5次。最后,用NETN洗一次;
6.吸出混合物的液体部分。加入800 ul的1xSDS胶加样缓冲液到球珠中,煮沸4 min;
7.将样品加入到大孔的不连续SDS-PAGE梯度胶中,在10 mA的恒定电流下电泳过夜;
8.通过考马斯亮蓝染色观察蛋白质泳带;
9.从胶上切下目标带,将其放到微量离心管中,用1 ml 50%乙腈洗两次,每次3 min;
10. 用胰蛋白酶消化胶中的蛋白质,再将肽电洗脱;
11. 通过窄孔高效液相色谱分离肽。将收集的肽在ABI 477A或494A机器上进行自动Edman降解测序。
注意事项
1. 细胞裂解采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质——蛋白质相互作用,多采用非离子变性剂(NP40 或Triton X-100)。每种细胞的裂解条件是不一样的,通过经验确定。不能用高浓度的变性剂(0.2%SDS),细胞裂解液中要加各种酶抑制剂,如商品化的。
2. 使用明确的抗体,可以将几种抗体共同使用。
3. 使用对照抗体:
单克隆抗体:正常小鼠的IgG或另一类单抗
兔多克隆抗体:正常兔IgG
4. 确保共沉淀的蛋白是由所加入的抗体沉淀得到的,而并非外源非特异蛋白,单克隆抗体的使用有助于避免污染的发生。
5. 要确保抗体的特异性,即在不表达抗原的细胞溶解物中添加抗体后不会引起共沉淀。
6. 确定蛋白间的相互作用是发生在细胞中,而不是由于细胞的溶解才发生的,这需要进行蛋白质的定位来确定。
常见问题
一、免疫共沉淀的优点
1. 相互作用的蛋白质都是经翻译后修饰的,处于天然状态。
2. 蛋白的相互作用是在自然状态下进行的,可以避免人为的影响。
3. 可以分离得到天然状态的相互作用蛋白复合物。
二、免疫共沉淀的缺点
1. 可能检测不到低亲和力和瞬间的蛋白质-蛋白质相互作用;
2. 两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用;
3. 必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。
三、RIPA Buffer配制
1. 基础成分
Tris-HCl(缓冲液成分,防止蛋白变性)
NaCl(盐份,防止非特异蛋白聚集)
NP-40(非离子去污剂,提取蛋白;用H2O配制成10%储存液)
去氧胆酸钠(离子去污剂,提取蛋白;用H2O配制成10%储存液;避光保存)
注意:准备激酶(致活酶)实验时,不要加去氧胆酸钠,因为离子型去污剂能够使酶变性,导致活性丧失。
2. RIPA蛋白酶抑制剂
苯甲基磺酰氟(PMSF)(用异丙醇配制成200 mM的储存液,室温保存)
EDTA(钙螯合剂;用H2O配制成100 mM的储存液,PH 7.4)
亮抑酶肽(Leupeptin)(用H2O配制成1 mg/ml的储存液,分装,-20℃保存)
抑蛋白酶肽(Aprotinin)(用H2O配制成1 mg/ml的储存液,分装,-20℃保存)
胃蛋白酶抑制剂(Pepstatin)(用甲醇配制成1 mg/ml的储存液,分装,-20℃保存)
3. RIPA磷酸(酯)酶抑制剂
激活的Na3VO4(用H2O配制成200 mM的储存液
NaF(200 mM的储存液,室温保存)
注意:在准备做磷酸(酯)酶实验的时候,不加磷酸酯酶抑制剂。
四、工作液配制
1. 配制100 ml的modified RIPA buffe
(1)称取790 mg 的Tris-Base,加到75ml 去离子水中,加入900 mg的NaCl,搅拌,直到全部溶解,用HCl调节PH值到7.4。
(2)加10 ml 10%的NP-40。
(3)加2.5 ml 10%的去氧胆酸钠,搅拌,直到溶液澄清。
(4)加1 ml 100mM的EDTA,用量筒定容到100 ml,2-8℃保存。
(5)理论上,蛋白酶和磷酸酯酶抑制剂应该在使用当天同时加入(抑蛋白酶肽、亮抑酶肽、胃蛋白酶抑制剂各100 ul;PMSF、Na3VO4、 NaF各500 ul),但是PMSF在水溶液中很不稳定,30分钟就会降解一半,所以PMSF应该在使用前现加,其他抑制剂成分可以在水溶液中稳定5天。
来源:丁香实验