显微镜技术
最新修订时间:
简介
原理
普通光学显微镜的主要部分是物镜和目镜,为两组焦距较短的凸透镜,其成像原理见图1-1。

图1-1中为方便起见,物镜、目镜都以单块透镜表示。物镜的焦距(F1)短,目镜的焦距(F2)略长。物体AB位于物镜的2倍焦距和1倍焦距之间,所以在物镜的像方形成一个倒立的放大的实像A'B',该像位于目镜的1倍焦距以内,经目镜放大为虚像A"B”,A"B”位于观察者眼睛的明视距离内。
从图上可以看出,A"B”的视角比眼睛直接看AB时的视角大得多,所以我们用显微镜可以看清非常微小的物体,只是眼睛通过目镜所看到的不是物体本身,而是物体被物镜、目镜所成的已经放大了2次的倒立的像。
相差显微镜技术的基本原理是将经过透明物体的直射光延迟或提前1/4波长,并和绕射光产生干涉,使相位差变为振幅差。
如果产生的干涉为相长干涉,则振幅的同相量相加而变大,我们便看到较亮的部分;如果所产生的干涉为相消干涉时,则振幅异相量相消而变小,这部分就变得较暗。这样,变相位差为振幅差的结果,使原来透明的液体表现出明显的明暗差异,对比度增加,能更清晰地观察活细胞的细微结构。
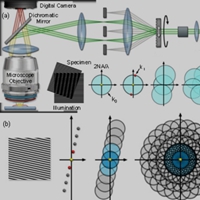
荧光显微镜采用高压汞灯作光源。汞灯是用石英玻璃制作,中间呈球形,内充一定数量的汞。工作时由两个电极间放电,引起汞蒸发,球内气压迅速升高,当汞完全蒸发时,可达50~70 atm(5~7 MPa),这一过程一般约需5~15 min。
超高压汞灯的发光是电极间放电使汞分子不断解离和还原过程中发射光量子的结果,它发射紫外到红色各色光,其中强紫外和蓝紫光等短波光足以激发各类荧光物质。
光源发出的光经过激发滤片后,选择性地透过可使标本产生荧光的特定波长的短波激发光,同时阻挡对激发荧光没有用的光,短波激发光激发标本内的荧光物质发射出荧光,通过物镜和目镜放大,同时目镜前的阻断滤片阻挡掉没有被标本吸收的激发光,有选择地透过荧光,从而使观察者通过目镜可观察到清晰的荧光。
目前常用的落射式荧光显微镜的光路图见图1-6。
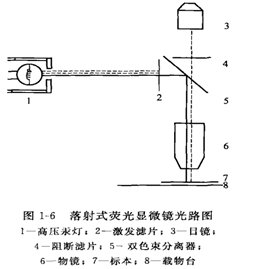
高压汞灯发出的光经激发滤片选择后,激发光经一个与光轴呈45°角的双色束分离器从物镜向下落射到标本表面,样品被激发产生的荧光以及盖玻片反射的激发光同时进入物镜,荧光可通过双色束分离器进入目镜,反射的激发光被双色束分离器阻挡,少量通过双色束分离器的激发光再被阻断滤片吸收。
如换用不同的激发滤片/双色束分离器/阻断滤片的组合插块,可满足不同荧光物质的需要。
透射电子显微镜技术的基本原理是以电子束作照明源,利用电子流的波动性,经电磁场的作用改变电子前进轨迹,产生偏转、聚焦,因此当电子束透过样品经电磁透镜的作用可放大成像。
高速运动的电子流其波长远比光波波长短,所以电镜分辨率比光镜高。一般光学显微镜放大倍数在数十倍到数百倍,特殊可到数千倍。而透射电镜的放大倍数在数千倍至一百万倍之间,有些甚至可达数百万倍或数千万倍。
由阴极发射的电子经高压加速、聚光镜聚焦形成快速电子流,投射到样品上,与样品中各种原子的核外电子发生碰撞,形成电子散射。细胞质量、密度较大的部位,电子散射度强,成像较暗;质量、密度较小的部位电子散射弱,成像较亮,结果在荧光屏上形成与细胞结构相应的黑白图像。
扫描电子显微镜的基本原理是由电子枪发射出一束极细的电子,在加速电压的作用下,形成高速电子流,经聚光镜和物镜汇聚成电子探针,在样品表面进行扫描。电子束可激发样品表面(厚约几纳米)使原子外层电子逸出,形成次级电子(同时也产生其他信号)。
次级电子的多少与电子束入射角有关,也就是说与样品的表面结构有关。击出的次级电子被检测器收集,经视频放大,形成图像信号,传入显像管显示。电子束照射样品表面与显像管荧光屏上的画面呈同步扫描,即样品表面图像定位点与电子束扫描定位点呈准确对应关系。结果荧光屏上形成样品表面图像,可直接观察和照相。
激光扫描共聚焦显微镜成像原理如图1-10所示,激光器发出的激光束经过扩束透镜和光束整形镜,变成一束直径较大的平行光束,长通分色反射镜使光束偏转90°,经过物镜会聚在物镜的焦点上,样品中的荧光物质在激光的激发下向各个方向发射荧光。
只有在物镜的焦平面上发出的荧光经过物镜、长通分色反射镜、聚焦透镜会聚在聚焦物镜的焦点处,再通过焦点处的针孔,由检测器接收(实线),其他位置发出的光均不能过针孔(虚线)。由于物镜和会聚透镜的焦点在同一光轴上,因而称以这种方式成像的显微镜为共聚焦显微镜。
在成像过程中针孔起着关键作用,针孔直径的大小不仅决定是以共聚焦扫描方式成像还是以普通光学显微镜扫描方式成像,而且对图像的对比度和分辨率有重要的影响。当激光逐点扫描样品时,针孔后的光电倍增管也逐点获得对应光点的共聚焦图像,并将之转化为数字信号传输至计算机,最终在屏幕上聚合成清晰的整个焦平面的共聚焦图像。
一个微动步进电机(最小步距可达0.1 μm)可驱动载物台的升降(沿z轴),使焦平面依次位于标本的不同层面上,可以逐层获得标本相应的光学横断面的图像,这称为“光学切片”(optical sectioning)。
再利用计算机的图像处理及三维重建软件,可以得到高清晰度三维原色图像,并可沿x、y、z轴或其他任意角度来显示图像,还可沿x、y、z轴或其他任意角度来表现标本的外形剖面,十分灵活、直观地进行形态学观察。若间歇或连续扫描样品的某一个横断面(或一条线)并对其荧光进行定位、定性及定量分析,即可实现对该样品的实时监测。
激光捕获显微切割技术的基本原理是在高倍显微镜下,观察5~20 μm厚的组织切片,依据细胞或组织形态学特征、免疫组化表型,来选择目的细胞,然后按压与显微镜相连的激光器按钮,激光源发出的一束激光。
被激光对应部分的透明乙烯-乙酸乙烯共聚(ethylenevinyl acetate,EVA)膜吸收,温度迅速升至90 ℃左右使膜熔化,并在激光脉冲结束200ms内瞬间冷却,EVA膜与靶细胞结合,其结合力比靶细胞与载玻片间结合力更强;揭起EVA膜,被捕获的目的细胞即和EVA膜一起脱离切片上的其他组织。
在同一张切片上通过移动组织切片或EVA膜重复进行,捕获点可相互叠加以捕获足够的细胞;然后,连同膜一起放入裂解液,依据不同研究目的提取DNA、RNA、酶或者蛋白质。
来源:丁香实验团队
操作方法
普通显微镜由三部分组成:机械部分、照明部分和光学部分,其中机械部分包括镜座、镜柱、镜臂、镜筒、物镜转换器、镜台和调节器,照明部分被包括反光镜、聚光器、光圈,光学部分有目镜和物镜两部分组成。
荧光显微镜技术一些化学物质经短波高能光激发后能吸收并储存能量而进入激发态,当其从激发态再回复到基态时,过剩的能量以荧光的形式发射。荧光发射的特点是在接受能量后即刻引起发光,而一旦停止供能,荧光现象也随之瞬间消失。各种荧光分子有其特定的吸收光谱和发射光谱(荧光光谱),即在某一特定波长处有最大吸收峰和最大发射峰,因此要观察不同的荧光应选用不同波长的激发光,得到的荧光强度才能最大。有些物质能够自发荧光,如维生素A的红
透射电子显微镜与超薄切片技术透射电子显微镜是一种用透过样品的电子束使其成像的高精密度的电子光学仪器。用于观察超微结构,即小于0.2 μm、光学显微镜下无法看清的“亚显微结构”。
扫描电子显微镜与样品制备技术扫描电子显微镜,是一种利用电子束扫描样品表面从而获得样品信息的电子显微镜。它能产生样品表面的高分辨率图像,且图像呈三维。
激光扫描共聚焦显微镜技术激光扫描共聚焦显微镜(laser scanning confocal microscopy,LSCM)是20世纪80年代发展起来的一项高新技术,是当今最先进的分子生学分析仪器之一。LSCM利用激光作为光源,在传统荧光显微镜成像的基础上加装激光扫描装置,通过使探测点与照明点共轭,有效地抑制来自非焦平面的荧光,从而具有高度纵向分辨率。使用紫外或可见光激发荧光探针,利用计算机软件进行图像处理,可得到细胞
激光捕获显微切割激光捕获显微切割(laser capture microdissection,LCM)是在显微镜下从组织切片中高选择地分离、纯化单一类型细胞群或单个细胞的新技术,使靶细胞群与转运膜在局部紧密黏合,选择性地捕获目的细胞群。
相关产品推荐
相关问答




![2,4-二氯-1-萘酚[用于照相技术],2050-76-2,≥97%(GC)(T),阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/923/2131019441498633081.jpg!wh200)