染色质免疫共沉淀法是基于体内分析发展的表观遗传信息研究的主要方法。
ChIP 不仅可以检测体内反式因子与 DNA 的动态作用,还可以用来研究组蛋白的各种共价修饰与基因表达的关系。
近年来,ChIP 与其他方法的结合,扩大了其应用范围,是深入分析转录调控的一种非常有效的工具,ChIP 与基因芯片相结合建立的 ChIP-on-chip 方法已广泛用于特定反式因子靶基因的高通量筛选;ChIP 与体内足迹法相结合,用于寻找反式因子的体内结合位点。
染色质免疫共沉淀法的基本过程可分为如下几步:
(一)细胞的甲醛交联与超声破碎
A. 在 10 cm 培养皿细胞中(9 ml 培养基),加入 243 μl 37% 甲醛,使得甲醛的终浓度为 1%,室温孵育 10 分钟。
B. 终止交联:加 450 μl 2.5 mol/L 甘氨酸于平皿中至甘氨酸至终浓度为 0.125 mol/L,混匀后在室温下静置 5 分钟。
C. 收集细胞:
①贴壁细胞:吸尽培养基,用预冷的 10 ml PBS 清洗细胞 2 次。用细胞刮刀收集细胞于 15 ml 离心管中。2000 r/min,4℃ 离心 5 分钟,收集细胞。
②悬浮细胞:转移细胞至 15 ml 离心管中,2000 r/min,4℃ 离心 5 分钟,收集细胞。用预冷的 10 mlPBS 清洗细胞 2 次。
D. 倒去上清,按照细胞量,加入预冷并含有新鲜添加蛋白酶抑制剂的 SDS Lysis Buffer(每 1x106 个细胞加 100 μl),冰上孵育 10 分钟。
E. 1000 r/min,4℃ 离心 10 分钟,小心弃上清。
F. 用含有新鲜加入蛋白酶抑制剂的 1 ml 细胞核裂解液 NLB 重悬沉淀,冰上孵育 10 分钟。
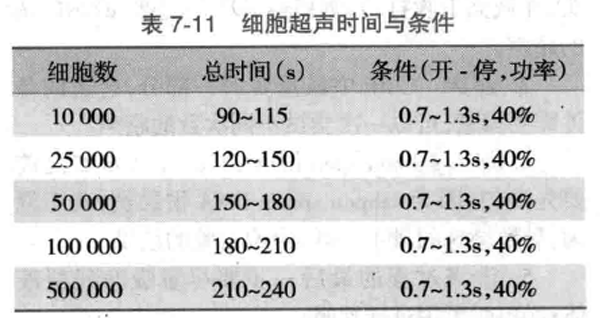
G. 超声破碎:40% 功率,0.7 秒冲击,1.3 秒间隙,超声时间根据细胞数来定,见表 7-11。冰上操作,避免出现泡沫。
(二)除杂及抗体哺育
A. 4℃ 高速离心 15 分钟,将上清转移到一个新的管子中。
B. 检测 DNA 含量(A260),染色质含量一般要求至少 750 ng/μl,A260/A280 在 1.4-1.6 之间。
C. 将上清稀释到 300 μl,加入 50 μl ProteinA/GAgarose/Salmon Sperm DNA 微珠,4℃ 旋转孵育 1-2 小时。
D. 3000 r/min,4℃ 离心 5 分钟,将上清转移到新管子中,加入相应抗体,4℃ 旋转孵育过夜。
(三)免疫复合物的沉淀及清洗
A. 孵育过夜后,每管中加入 50μl 蛋白 A/GAgarose/Salmon Sperm DNA 微珠。4℃ 旋转孵育 2 小时。
B.4℃ 3000 r/min 离心 2 分钟。
C. 取 15μl 上清作为 Input 对照,放在冰上待用。其余上清小心弃去。
D. 加入 1 ml 高盐洗液,室温旋转孵育 10 分钟。
E. 室温 3000 r/min 离心 2 分钟,小心弃上清,再加入 1 ml 高盐洗液,此过程重复 2 次,总共洗 4 次。
F. 小心弃上清,用 TE 同上法洗涤 2 次。
G. 用 300 μl 含蛋白酶 K(20 μg/μl)的洗脱液重悬微珠以及 Input 对照样品,55℃ 孵育 2 小时。
H. 解交联:每管中加入 20 μl 5 mol/L NaCl(NaCl 终浓度为 0.2 mol/L)。混匀,65℃ 解交联过夜。
(四)DNA 样品的回收与纯化
室温高速离心 5 分钟,将上清转移到新的离心管。然后按照通用 DNA 纯化方法提取 DNA。
(五)PCR 分析
A. 用半定量 PCR 或 Real-time 实时定量 PCR 检测目的 DNA 的含量。也可以将得到的 DNA 样品用于基因组 DNA 芯片分析,按照提供服务的公司要求准备样品。
1. 细胞计数应准确,否则会影响 Input 结果。
2. 用含 SDS 溶液重悬细胞一定要选用小的枪头,在液面下吹打,否则很容易产生气泡,影响后续的超声。
3. 超声 ChIP 中最重要的一部分,合适的条件需要摸索,可以一次尝试不同次数的超声。
4. 加入 salmon sperm DNA/Protein A or G 之前 要先混匀,因为 salmon sperm DNA 很黏稠,若不混匀,导致微珠的量不一样,影响实验的结果。
5. 洗涤过程的最后一步要尽量吸净残留液体,必要时可用进样器吸。
6. 含微珠的样品离心时,有的说明书上推荐是 1000 r/min,45 秒,可根据情况调整,但要注意转速不能太快防止微珠破碎(如果采用的是磁珠就不存在这个问题)。
7. 解交联后再进行下面步骤之前建议先离心,把蒸发到离心管盖子上的部分离心下来。
8. 注意抗体的性质。建议仔细查看抗体的说明书,特别是多抗。
9. 为防止蛋白的分解、修饰,溶解抗原的缓冲液中必须加蛋白酶抑制剂,低温下实验。每次实验之前,首先考虑抗体/缓冲液的比例。抗体过少就不能检出抗原,过多则不能沉降在微珠上,残存在上清。缓冲剂太少则不能溶解抗原,过多则抗原被稀释。
10. 每次进行 Real-time PCR 之前都要把样品离心保证取样的准确。1-10 μl 的枪取 3 μl 以上才比较准确,所以考虑好自己 PCR 反应体系的配制。








