是以抗体和抗原特异性结合作用为基础,用于研究蛋白质相互作用的经典方法,是确定两种蛋白质在哺乳细胞内生理性相互作用的有效方法。
抗体结合蛋白免疫共沉淀法的基本过程可分为如下几步:
(一)裂解细胞
A. 悬浮细胞:1400r/min,4℃ 离心 2 分钟收集细胞,用预冷 5 ml PBS 洗涤两遍,然后按 1 ml/10 个细胞用预冷的 RIPA 缓冲液来裂解细胞,冰上放置 20-60 分钟,12000r/min 离心 20 分钟,回收上清,即为细胞的蛋白裂解液。
B. 贴壁细胞:取预冷的 5 ml PBS 漂洗两次,加入细胞裂解液 1 ml(90 mm 平皿),直接裂解细胞并移入 1.5 ml 离心管中 4℃,12000r/min 离心 20 分钟→回收上清,即为细胞的蛋白裂解液。细胞裂解液短期可 4℃ 保存或于-80℃ 长期保存。
(二)沉淀抗原-抗体复合物
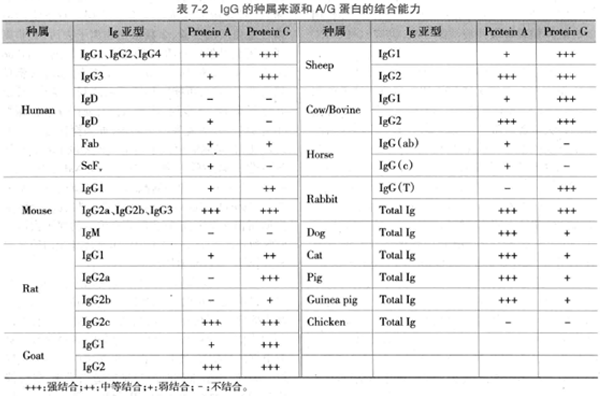
A. 蛋白 A/G Sepharose 准备:50%(V/V)蛋白 A/G-Sepharose 微珠,存放在 PBS 中,含 0.1%(W/V)叠氮钠,使用前需要用裂解缓冲液置换其溶液。取适量的蛋白 A/G-Sepharose 离心之后弃上清,用 2-5 倍体积裂解缓冲液洗涤 3 次,仍按 50%(V/V)悬浮。
B. 裂解物预清除(可选做):裂解物预清除可以帮助减少蛋白质非特异性结合到免疫球蛋白和 Agarose 或 Sepharose 微珠。用无关抗体或血清预清除以去除蛋白质与免疫球蛋白的非特异性结合。使最终实验结果背景降低、信噪比提高。但如果最后蛋白质是由免疫印迹实验检测,预清除未必必要,除非是污染蛋白质对靶蛋白质产生明显干扰。在 EP 管中加入 100-500 μg 细胞裂解物和 1-5 μg 无关抗体或抗血清,4℃ 孵育 30-60 分钟,然后加入 10-50μl 50% 蛋白 A/G 凝胶琼脂糖珠,4℃ 振荡孵育 30 分钟,微型离心机 12000r/min 4℃ 离心 5 分钟,保留上清液备用。
C. 免疫沉淀:在上清中加入 1-5 μg 识别靶蛋白的抗体,4℃ 孵育 1-2 小时,然后加入 10-50μl 的蛋白 A/G-Agarose 于 4℃ 在摇床上温和震荡 1 小时或过夜。微型离心机 4℃、12000r/min 离心 5 秒,弃上清。用 1 ml 冰冷裂解缓冲液重悬清洗沉淀物 3 次。最后一次离心后彻底吸弃上清液。
(三)蛋白质电泳分离(SDS-PAGE)
A. 安装电泳装置和玻璃板。
B. 配制分离胶:按照所需浓度和体积依次混合 H20,30% 丙烯酰胺,1。5mol/L Tris(pH8.8),10%SDS,10% 过硫酸铵,最后加入 TEMED,立即快速混匀。
C. 迅速在两玻璃板间隙灌入分离胶溶液,留出沉积胶所需体积和梳子齿长高度。小心地在胶上覆盖一层去离子 H20,垂直放置于室温中,约 30 分钟使胶凝聚。
D. 倒出分离胶上方覆盖液体,尽量吸干。
E. 配制 5% 浓缩胶,依次混合 H20,30% 丙烯酰胺,1。5mol/L Tris(pH8.8),10%SDS,10% 过硫酸铵,最后加入 TEMED,立即快速混匀。
F. 在分离胶上方灌入浓缩胶,并插入梳子,避免气泡!再灌入适量浓缩胶填满梳子齿间缝隙,垂直放置于室温。
G. 将蛋白样品加入等量 2 x SDS 加样缓冲液,100℃ 加热 3 分钟使蛋白变性。2000r/min,常温离心 3 分钟。
H. 取出浓缩胶中梳子,以 H2O 去除未聚合丙烯酰胺。将凝胶装置固定于电泳装置中,在上、下槽均加满 Tris-Glysine 电泳缓冲液。
L. 加样 10-20μl。
I. 将电泳装置通电,电压 8V/cm,当染料前沿进入分离胶后,电压提高到 15V/cm,电泳至溴酚蓝到达胶底部,约 2-4 小时。
J. 关闭电源,取出玻璃板,撬开玻璃板,小心取出凝胶。
(三)蛋白质印迹(半干式电印迹)
A. Tris/甘氨酸-SDS-聚丙烯酰胺凝胶电泳结束后,取出凝胶,在 Tris/甘氨酸缓冲液中漂洗数秒。
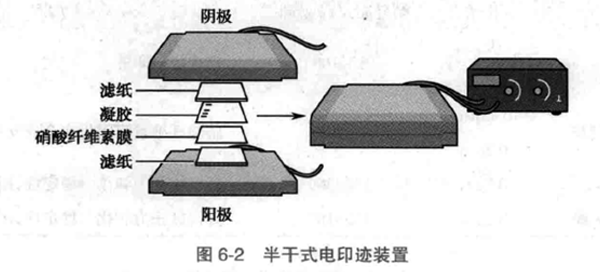
B. 安装印迹装置(图 6-2):戴手套操作,将阳极(石墨电极板)平放,蒸馏水淋洗,阳极板上放 3 张印迹缓冲液浸透的 3 mm 厚滤纸,用玻棒或滚筒轻轻碾压去除气泡!将印迹缓冲液浸透的硝酸纤维素膜放在滤纸上,再将凝胶平放在硝酸纤维素膜上,最后在凝胶上面加盖 1-3 张印迹缓冲液浸透滤纸,撵出气泡。滤纸、硝酸纤维素膜大小必须与胶大小一致,并精确对齐,否则多余的边缘互相接触会导致短路。在滤膜和凝胶剪一角或以铅笔作标记。
C. 在滤纸顶部压上阴极板,连接电极,根据凝胶的面积按 0.65mA/c㎡(微型胶常用 1-2mA/c㎡)接通电流(如 14 mm x 14 mm 凝胶电流<0.3A),经 1-1.5 小时电转印,电流降至相对平稳(如 14 mm x14 mm 凝胶电流降至 0.1A)时,切断电源,取出膜放置在 20 mmol/L pH7.5 Tris-HCl 缓冲液内,室温漂洗 10 分钟。凝胶可进一步采用考马斯亮蓝染色,观察蛋白残留量等。半干电转印装置如图 6-2 所示。
(四)靶蛋白的检测
A. 封闭
1)取漂洗的转印膜,放入含 5% 脱脂奶粉的 0.05mol/L pH7.5 Tris-HCl 封闭液内,在摇床上室温平缓摇动 1-2 小时,或 4℃ 过夜。
2)以 0.05mol/L、pH7.5 Tris-HCl,0.05%Tween20 洗液,漂洗一次,5-10 分钟。
注意事项:封闭 PVDF 膜需要比硝酸纤维素膜更高的奶粉或 BSA 浓度。封闭后的胶可冷冻长期保存,使用时用过量封闭液漂洗 10 分钟,而后检测。
B. 抗体特异结合
1)将封闭后的滤膜放入杂交袋中,加入抗体稀释液稀释的 1 ml Ab1(<10 cm x 8 cm 膜),封口机封口,4℃ 孵育过夜或室温摇动孵育 2-4 小时。
2)洗液洗膜 3 次,每次 5-10 分钟。
3)加入标记 Ab2,室温摇动孵育 2 小时。
4)洗膜 3-6 次,每次 5-10 分钟。
C. 显色/显影(辣根过氧化物酶 ECL 显色)
1)取 Western blot 用 ECL 试剂 A 和 B,用前在暗室内将 A、B 液各 1 ml 等量混合,加 2μl30% H2O20
2)在暗室内将抗体作用后印迹膜放入显色盒,加混和显色液 2 ml,约 1 分钟,出现明显发光带。
3)将印迹膜移入暗盒内,用保鲜膜包好,上面铺一张 X 线感光胶片,大约曝光 30-60 秒,取出 X 线片,显影、定影,结果可永久保存。该步骤现已常常应用仪器直接读取发光条带,以图片形式直接反应结果,操作简便。