类器官培养 50 问-应用篇
dxy_r0meq856
Q31: 用于疾病研究的类器官需要最大限度减小差异。但在实际培养过程中,同批次类器官个体之间、以及不同批次类器官样本之间均存在显著差异,这个问题怎样克服呢?
A31: 类器官是由不同类型的细胞组成的结构,并且在体外是自组装的,因此很容易存在同一样本在相同培养条件下的孔间差异。
如果是用于患者个性化医疗的肿瘤类器官,需要更精准地模拟患者体内的特征,这种情况建议采用多个平行来减小差异;
如果是用于机制研究或用作疾病模型的类器官,可以考虑利用“微流控液滴技术”进行工程化培养,相关成果已发表在 Cell Reports Medicine【1】。
Q32:目前培养出的类器官可以进行体内移植,用于器官重建吗?
A32:已有动物实验证实过可行性,比如:肠类器官移植小鼠治疗溃疡性结肠炎【2】;胰岛类器官移植小鼠治疗糖尿病【3】。
虽然目前类器官移植尚未进入临床,但在 2021 年 2 月,Science【4】首次报道了利用胆道类器官修复离体条件下的人类肝脏,实现了胆道再生,并改善了胆汁性质。
Q33:类器官一般长到什么程度可以用来进行药物测试?
A33:这个问题可以在 Nature Protocols【5】找到答案。
对于新鲜培养的类器官:建议对低代次类器官(2-3 代)进行药物筛选,以最大限度地减少使用过的培养基或体外突变累积对药物测试的影响。
对于经过冻存的类器官:由于冷冻/解冻可能导致复苏时器官样形态的变化,因此建议类器官至少传代一次再进行药物筛选。如果出现复苏后细胞活力不佳,则需要延长培养时间以恢复细胞状态。
Q34:类器官建立是否成功有怎样的标准吗?
A34:1、判断形态。显微镜下类器官形态可能为空泡状、出芽状、紧密型、松散型等,但整体形态一致。
2、可以鉴定相应的 biomarker 是否有表达,及分布是否与组织切片相似。
3、是否能够传代 3 次以上,并可以冻存复苏。
4、如果有条件的话,可以进行测序分析。
Q35:类器官可以进行基因编辑吗?
A35:可以,干细胞来源类器官的基因编辑多用于疾病建模,而肿瘤来源的类器官则多用于寻找疾病相关突变点或治疗靶点,图 1 列举了类器官基因编辑的部分研究和应用。
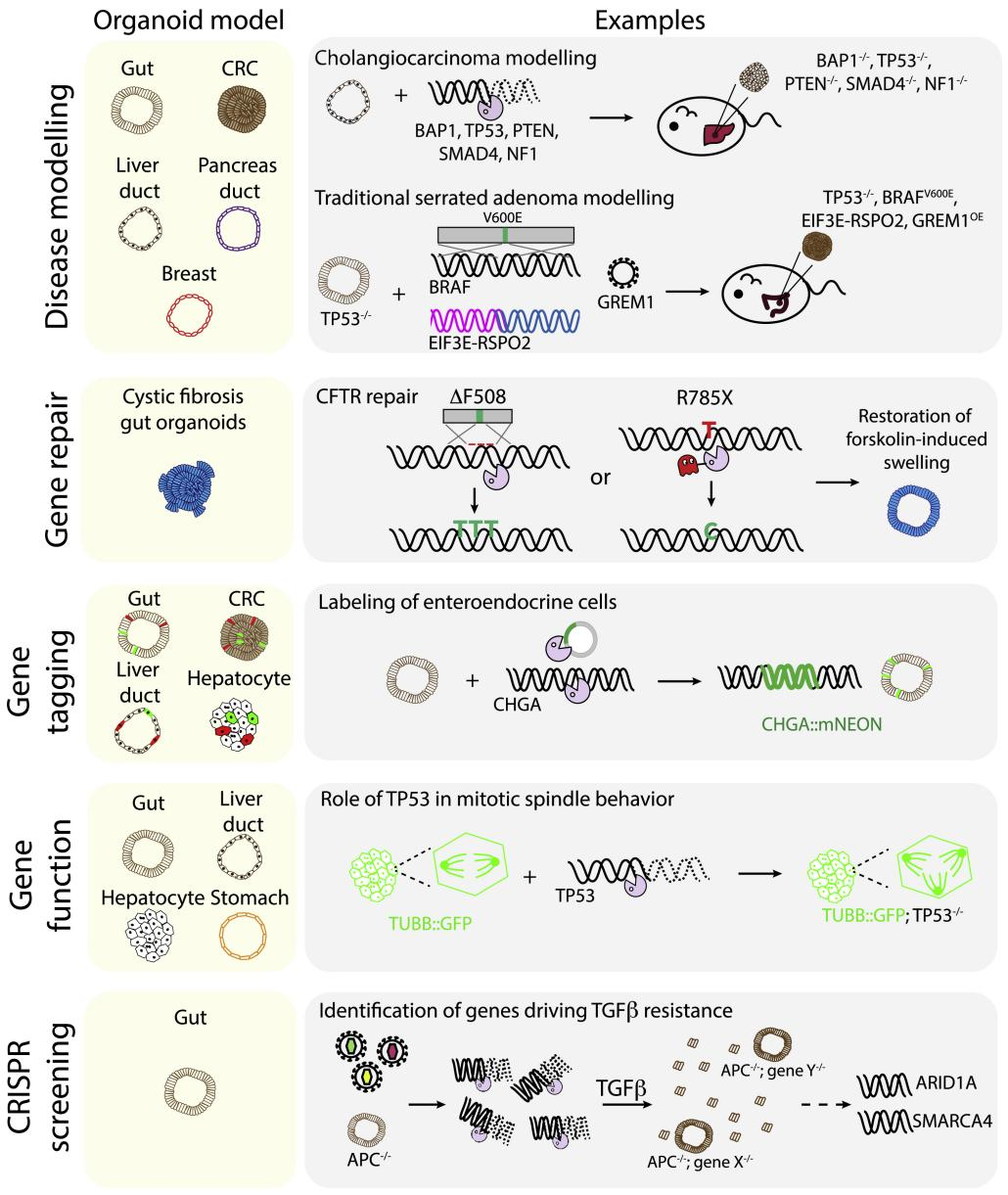
图1.类器官基因编辑的部分研究和应用【6】
Q36:类器官培养和普通细胞培养有何不同之处?
A36:1、细胞来源有区别:类器官的细胞来源是具有多能性的上皮细胞,而普通细胞培养适用于培养多种类型细胞;
- 细胞培养方式不同:类器官需要基质胶等材料支撑其三维结构,普通细胞培养则不需要;
- 类器官需要实现体外分化和自组装,因此需要多种细胞因子的组合进行诱导,培养基成分复杂。而普通细胞培养通常为单一种类细胞,因此培养基成分较简单;
Q37:用哪种培养基培养来自转移部位肿瘤的类器官,比如原发灶为 A 类型肿瘤,转移灶为 B 类型肿瘤?
A37:通常来讲,如果肿瘤发生了转移,我们依然选用相对应的原发灶(A 类型)PDO 培养基。
Q38: 怎样证明培养出的结构是类器官,而不是简单聚集在一起的细胞团?
A38:类器官的分化方式本质上是在模拟体内的器官发育,因此表达形态及各细胞分布情况与实际器官具有相似性,而细胞团则没有这种规律。我们可以通过免疫荧光的方式检测 biomarkers 的分布情况来区分。例如下图中的结果表明,肾类器官与肾组织的 biomarkers 分布高度一致【7】。
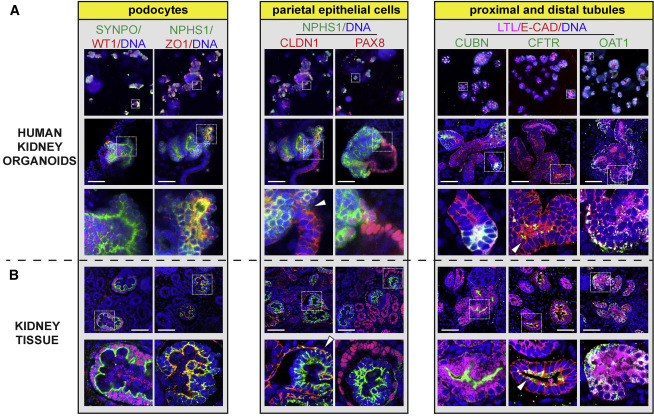
图 2. 肾类器官与肾组织的 biomarkers 分布高度一致【7】
Q39:类器官的的来源细胞必须要具有多能性吗?正常组织成熟体细胞可以进行类器官培养吗?
A39:由于类器官涉及到体外分化和自组装,因此来源细胞必须具有多能性。正常组织的成熟体细胞中往往会有一部分成体干细胞(标志物为 Lgr5,CD133 等),这部分细胞也可以进行类器官培养。
Q40:可以通过构建条件性培养基代替商品化的细胞因子吗?
A40:依据 Hans Clevers 实验室早期发表的文章,可以采用条件性培养基代替纯化的细胞因子进行类器官培养,但同时也需要考虑条件性培养基的不足之处。小编总结了条件性培养基和近岸细胞因子的参数差异。
表1. 条件性培养基和近岸蛋白细胞因子的参数差异
|
条件性培养基 |
近岸蛋白细胞因子 |
|
|
细胞因子含量和活性检测 |
含有多种蛋白质,不易检测,且每批次都要重新进行检测 |
单一蛋白质组分,能够提供准确的细胞因子含量和活性数据 |
|
纯度 |
含有大量细胞代谢产物,纯度较低 |
纯度可达到95%以上 |
|
储存 |
由于条件性培养基是液体,因此不论是短期冷藏保存,还是长期冻存,都会降低细胞因子活性 |
通常为冻干粉,可以长期保存而不影响活性 |
|
内毒素 |
通常没有去除内毒素的步骤 |
内毒素低于10EU/mg |
|
批间一致性 |
不能完全控制培养条件,批间一致性较差 |
重组技术表达,生产环节精准可控,批间差异小 |
总的来说,条件性培养基对于部分预实验或少量类器官培养是可行的,但鉴于质粒构建和验证消耗的时间,以及检测过程涉及的抗体、qPCR 等成本也是需要考虑在内的。同时,细胞代谢产物、内毒素和宿主残留物等也有可能影响实验结果。因此,选用高品质的商品化细胞因子能够帮您节约时间和金钱成本,快速推动类器官培养进程。
参考文献
【1】Jiang, Shengwei, et al.. (2020). An automated organoid platform with inter-organoid homogeneity and inter-patient heterogeneity. Cell Reports Medicine, 1(9), 100161.
【2】WATANABE, Satoshi, et al. Transplantation of intestinal organoids into a mouse model of colitis. Nature Protocols, 2022, 1-25.
【3】Wang, D. et al. (2020). Long-term expansion of pancreatic islet organoids from resident Procr+ progenitors. Cell, 180(6), 1198-1211.
【4】Sampaziotis, F. et al. (2021). Cholangiocyte organoids can repair bile ducts after transplantation in the human liver. Science, 371(6531), 839-846.
【5】Driehuis, E., Kretzschmar, K., & Clevers, H. (2020). Establishment of patient-derived cancer organoids for drug-screening applications. Nature protocols, 15(10), 3380-3409.
【6】Hendriks, D., Clevers, H., & Artegiani, B. (2020). CRISPR-Cas tools and their application in genetic engineering of human stem cells and organoids. Cell Stem Cell, 27(5), 705-731.
【7】Czerniecki, S. M. et al. (2018). High-throughput screening enhances kidney organoid differentiation from human pluripotent stem cells and enables automated multidimensional phenotyping. Cell stem cell, 22(6), 929-940.
4 个回答
sswei
人工智能全都回答了,不用修改全都正确。
feixue7758527w
写的很全面的,来学习一下,保留备存的。
高山云初
问题都是有答案的,感谢科普与分享
土井挞克树
最好的方法是提高综合度,模拟患者体内情况来减少误差
相关产品推荐
相关问答