材料与仪器
75% 乙醇,D-PBS,DMEM, Matrige,台盼蓝试剂,手术剪镊,生物显微镜,37℃ 恒温培养箱
步骤
1、取材
- 将小鼠断颈处死后,放在 75% 乙醇中浸泡 2 次, 转移至生物安全柜;
- 小鼠腹部向上摆放,用镊子轻轻夹起小鼠生殖口上 1cm 处皮毛,用剪刀以 V 形斜纵向剪开皮毛;
- 更换镊子和剪刀, 轻轻夹起腹膜以同样方式剪开腹膜。取近肛门端大约 10cm,去除盲肠部分,置于盛有冰 D-PBS 的 60mm 培养皿中,使用镊子去除肠道外部的膜、血管和脂肪。用注射器从结肠一端注入 D-PBS 反复冲洗,至内容物完全冲洗干净,放置于新的含预冷 D-PBS 的培养皿中;
- 使用手术剪将肠管剪开,肠腔面朝上,一只手使用手术镊夹住肠组织一端,另一只手使用无菌玻璃片轻轻刮肠腔表面。待肠绒毛被刮净后,加入 D-PBS 反复清洗 3~5 次。
2、消化
- 将清洗后的结肠组织剪成 2mm 左右的小段,放置于预冷的 D-PBS 中(含有 5mM EDTA)中,4℃ 消化 30min,每隔 10min 轻轻摇晃一次;
- 用镊子夹出结肠片段,放到盛有预冷 Advanced DMEM/F-12 的培养皿中,使结肠片段完全浸没在 Advanced DMEM/F-12 中以终止消化;
- 加入3~5ml 预冷的 D-PBS,用移液枪上下吹打结肠碎片 10~20 次,取部分悬液放置于载玻片上进行观察,若隐窝数量较少可适当增加吹打次数。将所得到的隐窝悬液用 100µm 的滤膜过滤,收集隐窝滤液;
- 将隐窝滤液充分重悬后,取部分悬液进行台盼蓝染色观察活率并计数。提取的隐窝应为 U 型(如图 1 示例);

图 1 小鼠结肠隐窝
- 将隐窝悬液与 Matrigel 在冰上混合(Matrigel 占比大于 70% 且混合液中隐窝密度为 8~20 个/μl,混合后的总体积约为 40μl),重悬时间不超过 30s 以避免 Matrigel 过早凝固;
- 将混合悬液接种在预热的 24 孔板底部正中央,每孔 30μl 左右,避免悬液接触孔板侧壁;
- 将接种完成后的培养板倒置置于37℃ 恒温培养箱中,孵育 15min 左右待 Matrigel 凝固;
- 待 Matrigel 完全凝固后,每孔加入 500μl 37℃ 预热的小鼠肠类器官完全培养基,确保 Matrigel 完全浸在培养基中;
- 将 24 孔板置于 37℃,5% CO2 的恒温培养箱中培养并持续观察。理想情况下,隐窝应在 2~4h 内变圆,并且有清晰的边界(如图 2 示例);
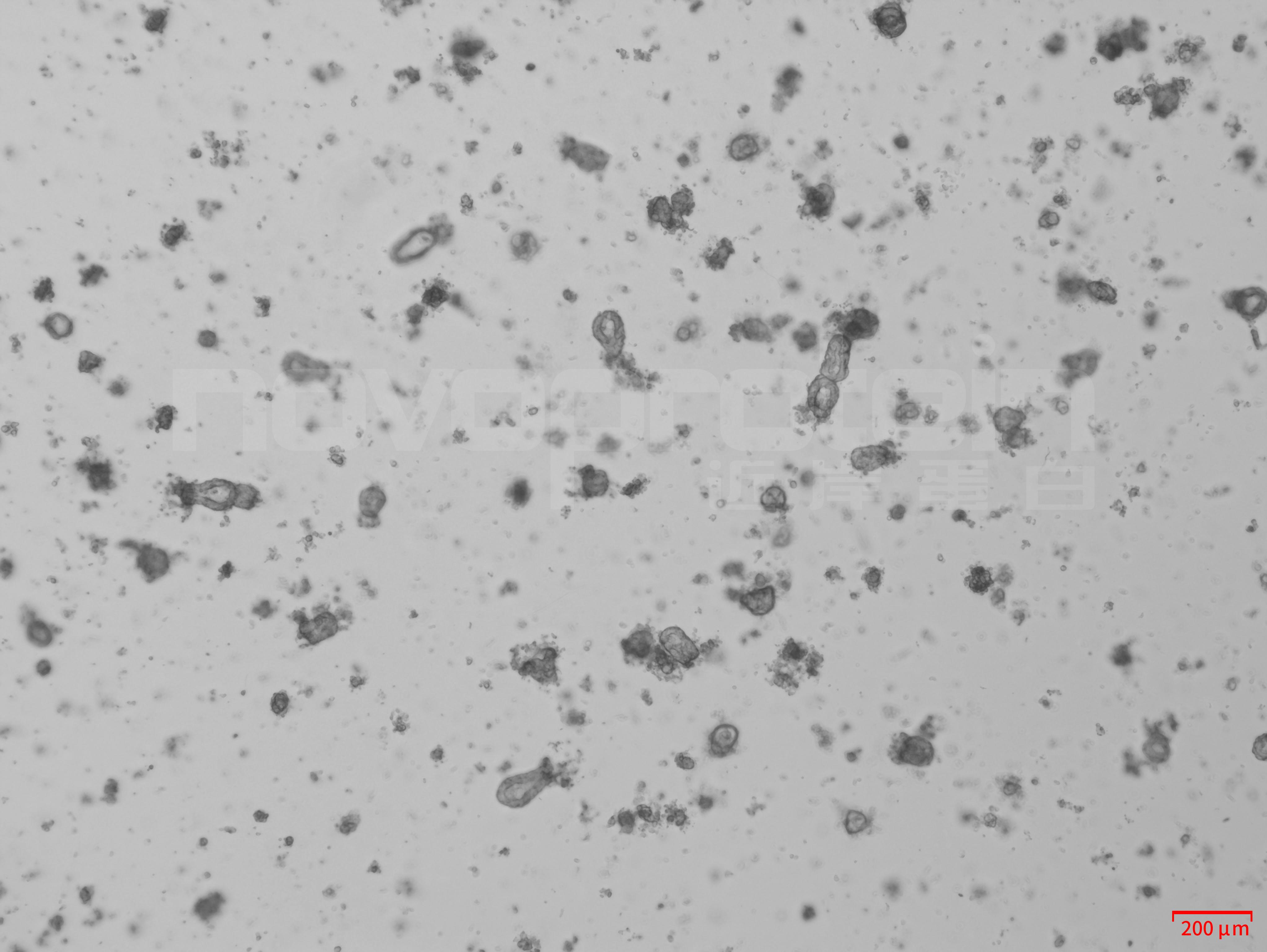
图 2 37℃ 培养 2h 后的隐窝大部分变圆
- 每 2-3 天更换一次培养基,更换培养基时应避免破坏 Matrigel;
- 密切监测类器官生长状态, 理想情况下, 小鼠结肠类器官应在 5~10 天内建成(如下图示例,显微镜下能够看到明显的出芽状态)。

图 3 成熟的小鼠结肠类器官
来源:丁香实验