类器官培养与应用——肝类器官
近岸蛋白
肝脏是人体中最大的器官之一,是调节营养吸收和代谢的主要器官,能够中和摄入的有毒化合物,并产生体内近 50% 的循环蛋白质。肝脏由多种细胞类型组成,其中占比最高的是功能多样的肝细胞。
肝脏作为重要的“解毒”器官,在执行日常功能时会受到各种代谢、病毒的侵害,可能会导致不同程度的肝损伤。长期损伤形成的纤维化疤痕破坏了肝脏的完整性,并且还会诱导门静脉高血压等其它疾病。在大多数肝脏疾病和药物诱导的肝损伤(DILI)中,损伤始于肝细胞,同时也会激活其它类型细胞(如:KC 和 HSC)。因此,为了充分理解每种肝病的表型和损伤器官的机制,我们需要建立复杂的体外肝模型,以便于更好地进行肝脏相关的疾病和毒性研究。
本篇文章基于 Nature protocol【1】和 Journal of hepatology【2】发表的两篇文章,整理了人类诱导多能干细胞(human iPSCs)来源的肝脏类器官培养方案。
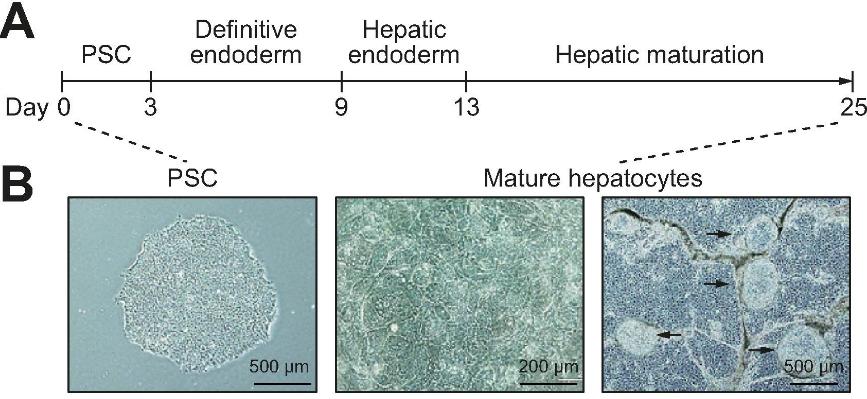
图 1. 人 iPSCs 来源的肝类器官培养方案【2】
细胞来源
Human iPSCs
培养基配方
|
MEFs培养基 |
iPSCs(I)培养基 |
iPSCs(II)培养基 |
DEs培养基 |
HEs培养基 |
HEs(II)培养基 |
HM培养基 |
EM培养基 |
DM培养基 |
近岸蛋白产品货号 |
|
|
基础培养基 |
DMEM-F12 |
RPMI-1640 |
RPMI-1640 |
RPMI-1640 |
RPMI-1640 |
HCM |
DMEM-F12 |
DMEM-F12 |
DMEM-F12 |
|
|
penicillin-streptomycin |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
|
|
dFBS(v/v) |
10% |
- |
- |
- |
- |
5% |
- |
- |
- |
|
|
KnockOut 血清替代物(KSR) |
- |
20% |
20% |
- |
- |
- |
- |
- |
- |
|
|
NEAA |
- |
1% |
1% |
- |
- |
- |
- |
- |
- |
|
|
GlutaMAX |
- |
1% |
1% |
- |
- |
- |
1% |
1% |
1% |
|
|
2-Mercaptoethanol |
- |
0.2% |
0.2% |
- |
- |
- |
- |
- |
- |
|
|
HEPES |
- |
- |
- |
- |
- |
- |
10mM |
10mM |
10mM |
|
|
N2 |
- |
- |
- |
- |
- |
- |
1× |
1× |
1× |
|
|
N-Acetylcysteine |
- |
- |
- |
- |
- |
- |
1mM |
1mM |
1mM |
|
|
Leu15-Gastrin I human |
- |
- |
- |
- |
- |
- |
10nM |
10nM |
10nM |
|
|
hEGF |
- |
- |
- |
- |
- |
- |
50ng/ml |
50ng/ml |
50ng/ml |
C029 |
|
hHGF |
- |
- |
- |
- |
- |
10ng/ml |
25ng/ml |
25ng/ml |
25ng/ml |
CJ72 |
|
B-27 |
- |
- |
- |
1% |
1% |
- |
1× |
1× |
1× |
|
|
A83-01 |
- |
- |
- |
- |
- |
- |
5μM |
5μM |
0.5μM |
|
|
Nicotinamide |
- |
- |
- |
- |
- |
- |
10mM |
10mM |
- |
|
|
Forskolin |
- |
- |
- |
- |
- |
- |
10μM |
10μM |
- |
|
|
R-Spondin |
- |
- |
- |
- |
- |
- |
- |
1μg/ml |
- |
CX83 |
|
FGF basic |
- |
100ng/ml |
5 ng/ml |
- |
10ng/ml |
- |
10ng/ml |
- |
- |
C046 |
|
FGF-10 |
- |
- |
- |
- |
- |
- |
- |
100ng/ml |
- |
CR11 |
|
FGF-19 |
- |
- |
- |
- |
- |
- |
- |
- |
100ng/ml |
CG74 |
|
Oncostatin M |
- |
- |
- |
- |
- |
20ng/ml |
10ng/ml |
- |
- |
C099 |
|
ITS |
- |
- |
- |
- |
- |
|
5μg/ml |
- |
- |
|
|
Dexamethasone |
- |
- |
- |
- |
- |
100nM |
100nM |
- |
3μM |
|
|
DAPT |
- |
- |
- |
- |
- |
- |
- |
- |
10μM |
|
|
BMP-4 |
- |
- |
- |
- |
20ng/ml |
- |
- |
- |
- |
|
|
BMP-7 |
- |
- |
- |
- |
- |
- |
- |
20ng/ml |
25ng/ml |
|
|
Activin A |
- |
- |
- |
100ng/ml |
- |
- |
- |
- |
- |
C687 |
|
ROCKi |
- |
- |
10μM |
- |
- |
- |
- |
- |
- |
iPSCs 培养和传代
1、将 100mm 培养皿包被 5ml 0.1%(w/v)的明胶,室温静置 15min 至明胶凝固。
2、在明胶上接种丝裂霉素处理过的 MEFs 细胞悬浮液,细胞数约为 1.8×106 个。放置在 37℃,5%CO2 的培养箱中培养至细胞汇合度 70-80% 时进行传代。
3、吸去 MEFs 培养基,将 iPSCs 接种于明胶上,添加 10ml iPSCs(I)培养基,放置在 37℃,5%CO2 的培养箱中培养 3-5 天。
定向内胚层分化
4、在 60mm 培养皿中加入 2ml Matrigel,室温静置 2h 并添加 DMEM-F12 培养基至完全没过 Matrigel。
5、用不含 Ca2+/Mg2+ 的 PBS 冲洗 iPSCs 后,加入 300μl Accutase,37℃ 孵育 3-4min。
6、将消化下来的细胞悬液收集并 90g 离心 5min,收集细胞沉淀并加入 iPSCs(II)培养基,同时进行细胞计数。
7、将 iPSCs 接种在 Matrigel 平板上,接种密度为 1.5×106 个/60mm 平皿,接种后添加 4ml iPSCs(II)培养基,放置在 37℃,5%CO2 的培养箱中过夜培养。
8、接种后第二天,用 DEs 培养基进行换液,放置在 37℃,5%CO2 的培养箱中培养 6 天,每 2 天换液一次。
肝内胚层分化
9、用 HEs 培养基进行换液,放置在 37℃,5% 低氧的培养箱中培养 3 天。
10、用 HEs(II)培养基进行换液,放置在 37℃,5% 低氧的培养箱中培养 4 天,之后转移至常氧条件下培养 8 天,达到肝成熟。
类器官培养
11、肝成熟后的 9-12 天,在单层肝细胞上会出现三维结构,此时将漂浮的囊泡状细胞收集起来,加入 Matrigel 并放置在 37℃ 条件下 10min 使 Matrigel 凝固。
12、添加 HM 培养基并完全没过 Matrigel 顶部,每 3 天更换培养基,每 7 天机械传代一次类器官。
类器官扩增和分化
13、将 HM 培养基吸出,用 PBS 清洗后,加入 EM 培养基,放置在 37℃,5% 低氧的培养箱中培养 4 天进行类器官扩增。
14、随后用 DM 培养基进行换液,放置在 37℃,5%CO2 的培养箱中培养 6 天,完成进一步分化。

图 2. 扩增培养基(EM)和分化培养基(DM)孵育后的肝类器官免疫荧光图【2】
肝类器官应用前景
类器官是一种能够进行体外更新和自组装的模型,相比于传统的二维(2D)细胞培养,类器官的生长环境更贴合生理条件。3D 培养的肝类器官可以用于疾病建模,以便确定疾病的机制以及治疗方法。研究表明,3D 培养的iPSC来源的肝类器官比 2D 干细胞更易感染乙型肝炎病毒【3】。2019 年 Ouchi, R.et al.【4】利用 iPSCs 来源的肝类器官,在体外模拟了炎症和纤维化,为进一步了解 Wolman 疾病打下了基础。
在药物毒性验证方面,肝类器官同样发挥着重要的作用。对乙酰氨基酚是药物引起肝衰竭的最常见来源,利用肝脏类器官可以实现药物的肝毒性验证,更适用于未来的药物筛选和开发【5】。
参考文献
【1】TAKEBE, Takanori, et al. Generation of a vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature protocols, 2014, 9.2: 396-409.
【2】MUN, Seon Ju, et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids. Journal of hepatology, 2019, 71.5: 970-985.
【3】Nie, Y. Z. et al.(2018). Recapitulation of hepatitis B virus–host interactions in liver organoids from human induced pluripotent stem cells. EBioMedicine, 35, 114-123.
【4】Ouchi, R. et al. (2019). Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids. Cell metabolism, 30(2), 374-384.
【5】Sgodda, M. et al. (2017). A scalable approach for the generation of human pluripotent stem cell-derived hepatic organoids with sensitive hepatotoxicity features. Stem cells and development, 26(20), 1490-1504.