类器官培养与应用——肾类器官
近岸蛋白
哺乳动物的肾脏包含数千个肾单位,互相连接成为高度分枝化的集气管(collecting duct, CD)系统。肾脏主要由两个胚胎细胞群的相互作用形成:上皮性输尿管芽(Ureteric bud,UB)和周围的后肾间质(Metanephric mesenchyme, MM),其中 MM 包含肾单位前体细胞(Nephron progenitors, NPs)和基质前体细胞(Stromal progenitors, SPs)【1】。在 MM 细胞的诱导下,UB 逐渐发育并形成分枝。MM 细胞聚集在UB的分枝尖端,形成帽状间充质,促进帽状间充质中的肾祖细胞增殖分化,形成聚集(Pre-tubular aggregate,PA)。随后,PA 和 UB 分别进行间充质-上皮细胞转化(Mesenchymal-epithelial transition, MET)和小管生成,进而形成肾单位【2】。目前广泛用于肾脏研究的人肾脏细胞系忽略了细胞外微环境,与在体的器官类型和整体特性仍存在较大差异,不能充分体现出肾脏的作用及其特点,而三维培养的肾类器官模型为肾脏的研究提供了新途径。人源多能干细胞衍生的肾脏类器官是一种由干细胞分化而来,具有一定肾脏功能的组织结构。可以模拟肾脏发育和疾病发生,用于肾脏疾病的细胞修复治疗、筛选改善肾功能药物等场景。
本篇文章基于 Cell Stem Cell【3-4】和 Nature Biotechnology【5】发表的三篇文章,整理了人诱导多能干细胞(hiPSCs)来源的肾类器官培养方案。该培养过程遵循发育原理,由多能干细胞诱导得到 UBs 及 NPs 细胞。配合 SPs 细胞,有望实现体外培养具有肾脏高阶结构的人肾脏类器官。因为缺乏诱导SPs形成的方法,并且无法获得人胚胎肾组织中的 SPs,目前这个方案只在小鼠 ESCs 验证过有效性和可行性。
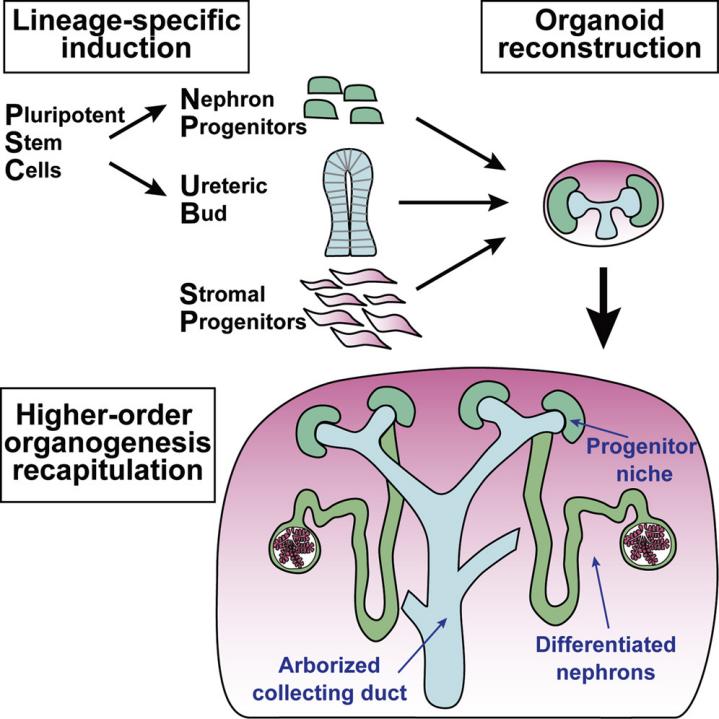
图 1. 具有肾脏高阶结构的肾脏类器官培养方案示意图【3】
细胞来源
hiPSCs
培养试剂配方
|
|
|
UB谱系诱导 |
NP谱系诱导 |
近岸蛋白产品货号 |
|||||||||||
|
|
hiPSCs培养基 |
hiPSCs分化培养基 |
Step 1培养基 |
Step 2培养基 |
Step 3培养基 |
Step 4培养基 |
Step 5培养基 |
Step 6培养基 |
Step 7培养基 |
分枝形成培养基 |
NP培养基 |
中胚层诱导培养基 |
ABC3R培养基 |
C1F培养基 |
|
|
基础培养基 |
Knockout DMEM |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
|
|
Penicillin-Streptomycin |
0.5% |
0.5% |
0.5% |
0.5% |
0.5% |
0.5% |
0.5% |
0.5% |
0.5% |
- |
0.5% |
0.5% |
0.5% |
0.5% |
|
|
FBS |
- |
- |
- |
- |
- |
- |
- |
- |
- |
10% |
- |
- |
- |
- |
|
|
KnockOut Serum Replacement |
20% |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
L-glutamine |
2 mM |
2 mM |
2 mM |
2 mM |
2 mM |
2 mM |
2 mM |
2 mM |
2 mM |
- |
2 mM |
2 mM |
2 mM |
2 mM |
|
|
NEAA(without RA) |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
- |
1% |
1% |
1% |
1% |
|
|
RA |
- |
- |
- |
- |
0.1 μM |
0.1 μM |
0.1 μM |
0.1 μM |
0.1 μM |
0.1 μM |
- |
- |
0.1 μM |
- |
|
|
Y-27632 |
- |
- |
10μM |
- |
- |
- |
10μM |
10 μM |
10 μM |
- |
10μM |
10 μM |
10 μM |
10 μM |
|
|
B27 |
- |
2% |
2% |
2% |
2% |
2% |
2% |
2% |
2% |
- |
2% |
2% |
2% |
2% |
|
|
CHIR99021 |
- |
- |
- |
10μM |
- |
5μM |
1μM |
3 μM |
3 μM |
- |
- |
10μM |
3 μM |
1 μM |
|
|
Activin A |
- |
- |
10 ng/ml |
- |
- |
- |
- |
- |
- |
- |
1 ng/ml |
- |
10 ng/ml |
- |
C687 |
|
BMP-4 |
- |
- |
1 ng/ml |
1 ng/ml |
- |
- |
- |
- |
- |
- |
- |
- |
3 ng/ml |
- |
|
|
FGF-1 |
- |
- |
- |
- |
- |
- |
100 ng/ml |
100 ng/ml |
100 ng/ml |
100 ng/ml |
- |
- |
- |
- |
|
|
FGF-2 |
5ng/ml |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
C779 |
|
FGF-7 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
30 ng/ml |
- |
- |
- |
- |
CH73 |
|
FGF-9 |
- |
- |
- |
- |
100 ng/ml |
100 ng/ml |
5ng/ml |
5 ng/ml |
- |
- |
- |
- |
- |
5 ng/ml |
C198 |
|
GDNF |
- |
- |
- |
- |
- |
- |
- |
1 ng/ml |
2 ng/ml |
2 ng/ml |
- |
- |
- |
- |
C226 |
|
R-spondin 1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
100 ng/ml |
- |
- |
- |
- |
CX83 |
|
LDN193189 |
- |
- |
- |
- |
100 nM |
30 nM |
10 nM |
10 nM |
10 nM |
10 nM |
- |
- |
- |
- |
|
|
SB431542 |
- |
- |
- |
- |
100 μM |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
ITS |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
- |
1% |
1% |
1% |
1% |
|
|
β-mercaptoethanol |
90μM |
90μM |
90μM |
90μM |
90μM |
90μM |
90μM |
90μM |
90μM |
- |
90μM |
90μM |
90μM |
90μM |
|
|
Matrigel (growth factor-reduced) |
- |
- |
- |
- |
- |
- |
10% |
10% |
10% |
50% |
- |
- |
- |
- |
一、hiPSCs培养
1、将 hiPSCs 接种在用丝裂霉素 C 处理过的小鼠胚胎成纤维细胞(MEFs)上。
2、加入 1mg/ml 胶原酶 IV,将 iPSCs 克隆团从 MEFs 中分离出来。
3、随后将分离出的 iPSCs 克隆团收集到锥形管中,静置 10min 使 iPSCs 克隆团沉淀,弃掉上清液中的 MEFs。
4、沉淀的 iPSCs 克隆团用 Accutase 分离。
二、输尿管芽(Ureteric bud, UB)谱系诱导
拟胚体(Embryoid bodies, EB)分化
5、将分离的 iPSCs 转移至 V 型底低吸附的 96 孔板中,加入 iPSCs 分化培养基培养。当细胞/克隆团数达到 10,000 个时,用 Step1 培养基换液,细胞将重新聚合成EB。
6、培养 24h 后,将 EB 转移到 U 型底低吸附的 96 孔板中,加入 Step2 培养基,培养 36h。
7、将细胞用 Step3 培养基换液,培养 48h。
8、将细胞用 Step4 培养基换液,培养 42h。
中肾管(Wolffian duct, WD)前体细胞成熟
9、将上清吸出,加入 0.25% 胰酶/EDTA 至没过细胞,37℃ 消化 6min 解离细胞球。
10、血清封闭后,加入含有 CXCR4/KIT 抗体的稀释液(含 1×HBSS, 1% BSA 和 0.035% NaHCO3),进行流式分选细胞。
11、分选出的阳性细胞(约 5,000 个)种在 V 型底低吸附的 96 孔板中,210 × g 离心 4 min。
12、将细胞用 Step5 培养基换液,培养 54h。
13、将细胞转移至含有 Step6 的培养孔中,培养 48h。
14、将细胞转移至含有 Step7 的培养孔中,培养 72h,形成 UB 球体。
诱导输尿管芽(Ureteric bud, UB)分枝形成
15、将 UB 球体转移至 24 孔 Transwell 中,加入 150μl 分枝形成培养基。下层培养基为无 Matrigel 的分枝形成培养基。
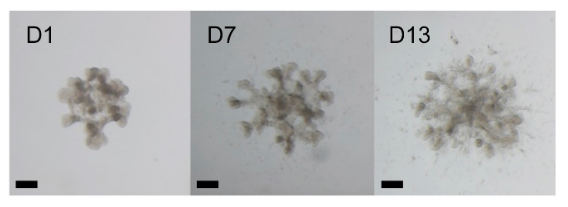
图 2. 光镜下 UB 分枝形态,比例尺, 200 μm【3】
三、肾单位前体细胞(Nephron progenitors, NP)谱系诱导
5-2、将步骤 4 中的 iPSCs 转移至 V 型底低吸附的 96 孔板中,当细胞/克隆团达到 10,000 个时,用 NP 培养基换液,细胞将重新聚合成 EB。
6-2、培养 24h 后,将 EB 转移到 U 型底低吸附的 96 孔板中,加入中胚层诱导培养基,每隔一天进行半换液,培养 6 天。
7-2、将细胞用 ABC3R 培养基换液,培养 48h。
8-2、将细胞用 C1F 培养基换液,形成 NP。
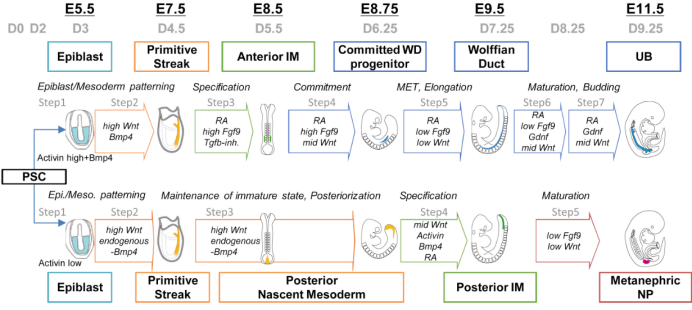
图 3. UB 和 NP 的谱系分化模型【3】
用于再生医学肾脏类器官
慢性肾病(Chronic kidney disease, CKD)目前影响全球 11-13% 的人口,其患病率正在增加。老年人慢性肾病的高患病率是年龄和心血管危险因素共同作用的结果,而青少年最常见的病因是小儿肿瘤(例如肾母细胞瘤)和先天性肾脏和泌尿道异常(CAKUT)。目前全世界有 200 万人依赖透析,而没有肾移植的选择。鉴于透析的高死亡率和社会经济负担,迫切需要替代的治疗方法。再生医学领域旨在以源自人类多能干细胞(hPSC)的肾脏类器官的形式进行疾病治疗,从健康供体或肾病患者产生的 hPSCs 还可以解决免疫相容性和患者特异性的问题。基于此,目前已有多项研究构建了不同成熟度的肾脏类器官(如图 4),距离肾脏类器官的临床应用已经越来越近了。
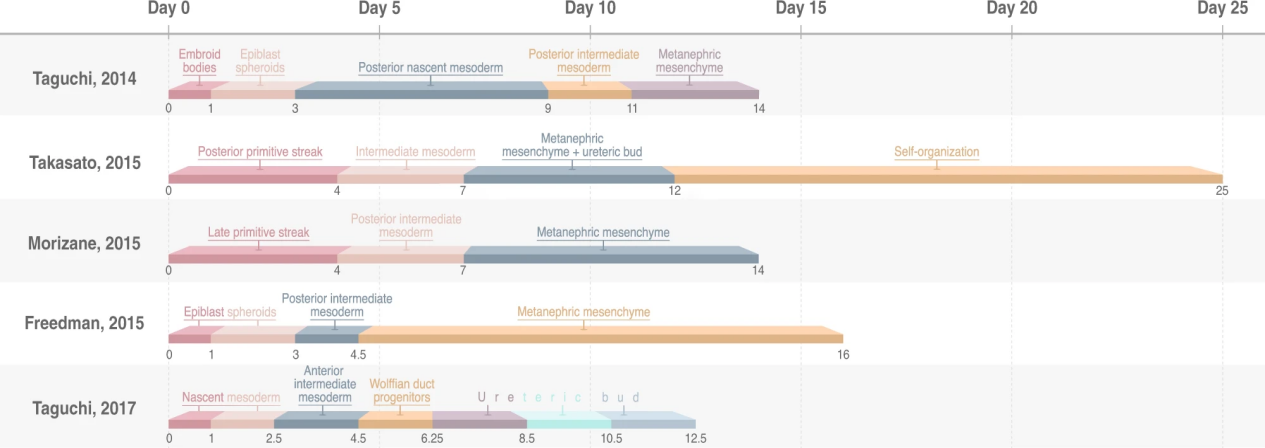
图 4. hPSC 来源肾脏类器官的多种培养方案【6】
参考文献
【1】Zeng Z, Huang B, Parvez R K, et al. Generation of patterned kidney organoids that recapitulate the adult kidney collecting duct system from expandable ureteric bud progenitors[J]. Nature Communications, 2021, 12(1): 3641.
【2】Nishita M, Qiao S, Miyamoto M, et al. Role of Wnt5a-Ror2 signaling in morphogenesis of the metanephric mesenchyme during ureteric budding[J]. Molecular and cellular biology, 2014, 34(16): 3096-3105.
【3】Taguchi A, Nishinakamura R. Higher-order kidney organogenesis from pluripotent stem cells[J]. Cell stem cell, 2017, 21(6): 730-746. e6.
【4】Taguchi A, Kaku Y, Ohmori T, et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells[J]. Cell stem cell, 2014, 14(1): 53-67.
【5】Oldershaw R A, Baxter M A, Lowe E T, et al. Directed differentiation of human embryonic stem cells toward chondrocytes[J]. Nature biotechnology, 2010, 28(11): 1187-1194.
【6】Geuens T, van Blitterswijk C A, LaPointe V L S. Overcoming kidney organoid challenges for regenerative medicine[J]. NPJ Regenerative medicine, 2020, 5(1): 8.