类器官培养与应用——胰岛类器官
近岸蛋白
胰腺是分泌血糖稳态激素的重要器官,是人体内控制血糖动态平衡的中心。胰腺的内分泌功能主要是由胰岛来完成的,每个胰岛都是一个复杂的微器官,由上千个分泌细胞组成。经典的胰岛内分泌细胞包括 α 细胞、β 细胞、δ 细胞、ε 细胞和 PP 细胞,分别主要产生胰高血糖素(glucagon)、胰岛素、生长抑素(SS)、生长素释放肽及胰多肽,其在成体胰岛内分别约占 20%、75%、3%~5%、1% 和<2%【1】。
胰岛移植为 I 型和晚期 II 型糖尿病患者提供了卓越的长期血糖控制,但是成体胰岛组织的可用量限制了这一治疗方案的广泛应用。目前诱导多能干细胞(iPSC)分化为产生胰岛素的 β 样细胞是一项重大进展。2021 年美国食品和药物管理局(FDA)已授予 VX-880(一种 iPSC 细胞在体外诱导分化而来的胰岛 β 细胞)快速通道指定,目前已启动 VX-880 的临床试验,用于治疗严重低血糖和低血糖意识受损的 1 型糖尿病(T1D)患者。在 2023 年 6 月举办的美国糖尿病协会 (ADA) 第 83 届科学会议上公布了正在进行的 VX-880 临床试验的积极结果:所有接受 VX-880 治疗的患者均在治疗前一年内胰岛素分泌检测不到,且有反复发生严重低血糖事件 (SHE) 的病史;治疗后,所有 6 名患者均表现出胰岛素分泌恢复、血糖控制改善、时间范围改善、外源性胰岛素使用减少或消除,并且在第 90 天后的评估期间完全没有发生不良反应【2】。
类器官是一项新兴技术,与动物模型相比,类器官可以完全是人类细胞来源的;与人源器官相比,类器官更容易获得,并且可以定向分化;与组织来源的原代细胞相比,类器官独有的多细胞类型和三维培养模式,能够更好地模拟体内的结构和功能【3】。
本篇文章基于 Nature Communications【4-5】和 Cells【6】发表的三篇文章,整理了人多能干细胞(hPSC)来源的胰岛样类器官培养方案。该培养过程遵循发育原理,由 hPSC 依次分化为定型内胚层 (DE)、胰腺祖细胞 (PP)、内分泌前体 (EP), 最终诱导发育为人胰岛样类器官(human Islet-like Organoid, hILO)。
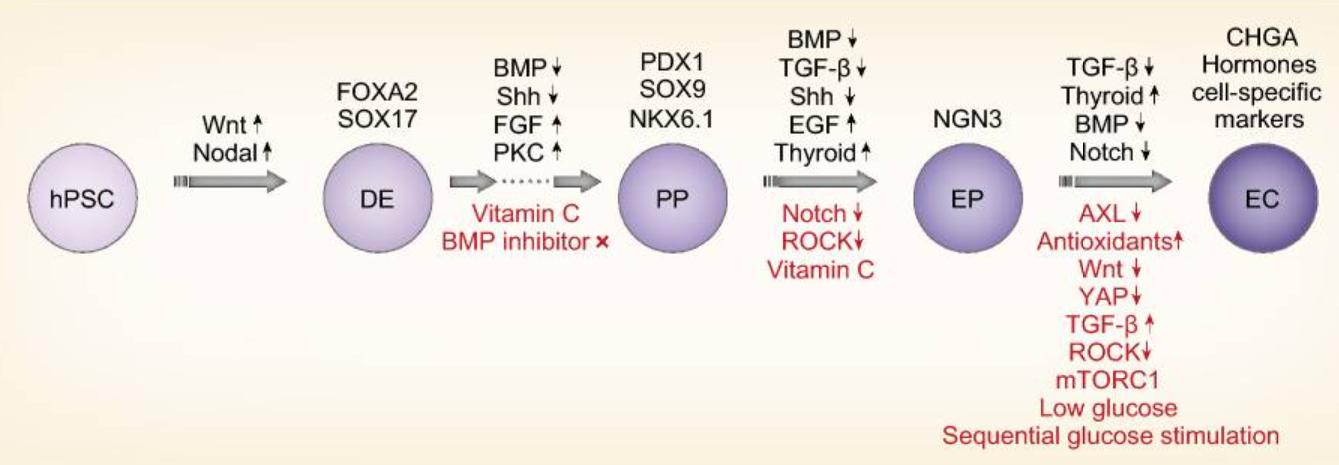
图 1. hPSC 来源细胞诱导成为胰岛样类器官的培养方案示意图【7】
细胞来源
hPSC
培养试剂配方
|
包被液 |
hPSC培养基 |
Day1 |
Day2 |
Day3 |
Day4-Day6 |
Day7-Day8 |
Day9-Day14 |
Day15-Day22 |
Day23-Day30 |
近岸蛋白产品货号 |
|
|
基础培养基 |
DPBS |
Essential 8 |
RPMI |
RPMI |
RPMI |
RPMI |
DMEM |
DMEM |
DMEM |
DMEM |
|
|
FBS |
- |
- |
- |
0.2% |
2% |
- |
- |
- |
- |
- |
|
|
Vitronectin |
5μg/mL |
- |
- |
- |
- |
- |
- |
- |
- |
- |
C395 |
|
BSA |
- |
- |
- |
- |
- |
0.05% |
0.05% |
0.05% |
0.05% |
0.05% |
|
|
Penicillin-Streptomycin-amphotericin B |
- |
1% |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Penicillin-Streptomycin |
- |
- |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
|
|
B27 |
- |
- |
- |
- |
- |
0.5× |
1× |
1× |
1× |
1× |
|
|
N2 |
- |
- |
- |
- |
- |
0.5× |
- |
- |
- |
- |
|
|
CHIR99021 |
- |
- |
3 μM |
- |
- |
- |
- |
- |
- |
- |
|
|
Activin A |
- |
- |
100 ng/ml |
100 ng/ml |
100 ng/ml |
- |
- |
- |
- |
- |
C687 |
|
KGF |
- |
- |
- |
- |
- |
50ng/ml |
50ng/ml |
- |
- |
- |
CH73 |
|
Vitamin C |
- |
- |
- |
- |
- |
- |
0.25mM |
0.25 mM |
0.25 mM |
0.25 mM |
|
|
LDN-193189 |
- |
- |
- |
- |
- |
- |
0.1μM |
0.1 μM |
0.1 μM |
- |
|
|
GDC-0449 |
- |
- |
- |
- |
- |
- |
0.1μM |
- |
- |
- |
|
|
Retinoic Acid |
- |
- |
- |
- |
- |
- |
2μM |
- |
- |
- |
|
|
EGF |
- |
- |
- |
- |
- |
- |
- |
50ng/ml |
- |
- |
C029 |
|
Zinc Sulfate |
- |
- |
- |
- |
- |
- |
- |
- |
10μM |
10 μM |
|
|
Heparin |
- |
- |
- |
- |
- |
- |
- |
- |
10μg/ml |
10μg/ml |
|
|
616452 |
- |
- |
- |
- |
- |
- |
- |
- |
10μM |
10 μM |
|
|
T3 |
- |
- |
- |
- |
- |
- |
- |
- |
1μM |
1 μM |
|
|
Compound E( γ-Secretase-IN-1) |
- |
- |
- |
- |
- |
- |
- |
- |
0.1μM |
- |
|
|
N-acetyl cysteine |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1mM |
|
|
Trolox |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1μM |
一、hPSC 培养
1、将 hPSC 接种在 Vitronectin 包被的 6 孔板上,加入 hPSC 培养基进行扩增培养。
2、传代时加入 Accutase,将 hPSC 消化成单细胞。
3、用 DPBS 清洗两次后,接种到用 Vitronectin 包被的 12 孔板中,接种密度为 1.0 × 104 个细胞/cm2。
4、在传代培养的第一天加入含 10 mM Y-27632 的 hPSC 培养基,之后用 hPSC 培养基换液。37℃,5% CO2 培养 48 小时。
5、用 DPBS 清洗两次后,进入后续的分化步骤。
二、诱导形成胰岛样类器官
6、每天按照对应的培养基换液,培养到第 15 天时细胞聚成悬浮的小球。
7、继续按照对应的培养基换液,37℃,5% CO2 继续培养至 30 天。
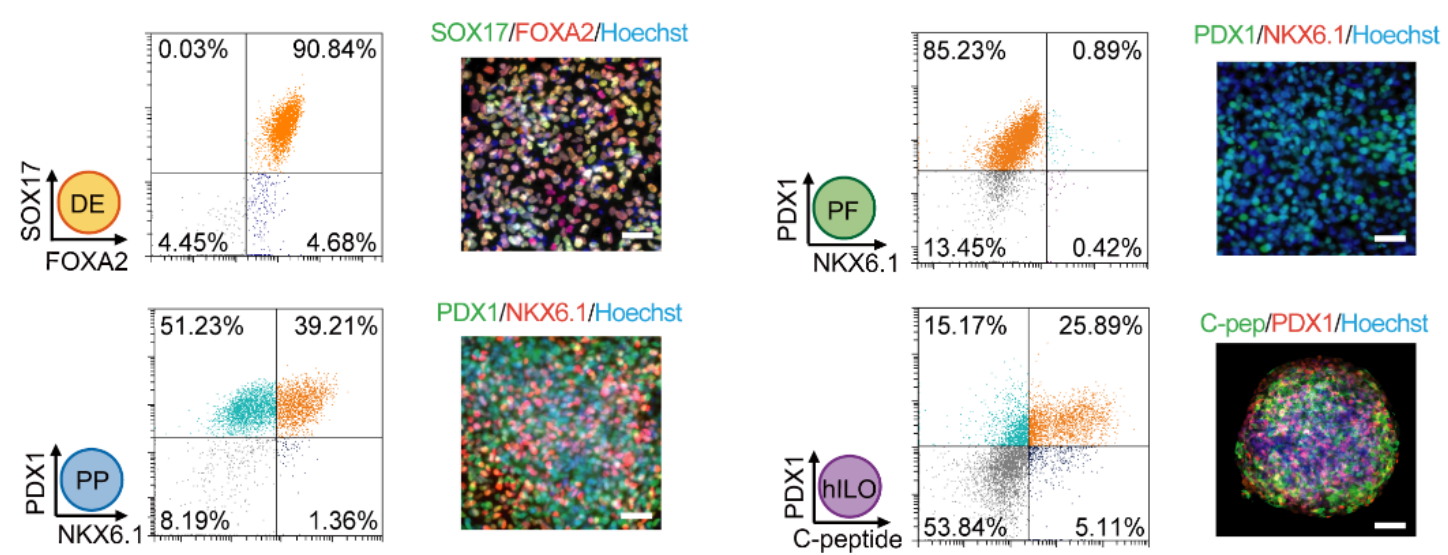
图 2. 流式和免疫荧光鉴定。hPSC 诱导形成的 DE、PF、PP 和 hILO 能够正常表达各自的标记物【4】。标尺,100 μm
可用于医学研究的胰岛样类器官
随着技术的不断进步,胰岛样类器官的发育和功能越来越接近生理条件下的胰岛组织,胰岛样类器官可以在某些场景下作为人类胰岛的替代品。
长期以来,由于动物模型不能完全模拟人的疾病特征,糖尿病研究一直缺乏真实的疾病模型。基于干细胞的胰岛样类器官忠实地模拟了胰岛的发育过程【8】,并具有与天然胰岛相似的形态结构和细胞组成。将基因编辑技术(如 CRISPR/Cas9)和 iPSC 分化技术的结合,能够通过操纵胰岛样类器官来研究正常和糖尿病人胰岛的发育【9】、功能和病理机制,在促进药物筛选和自体胰岛移植方面具有巨大前景。
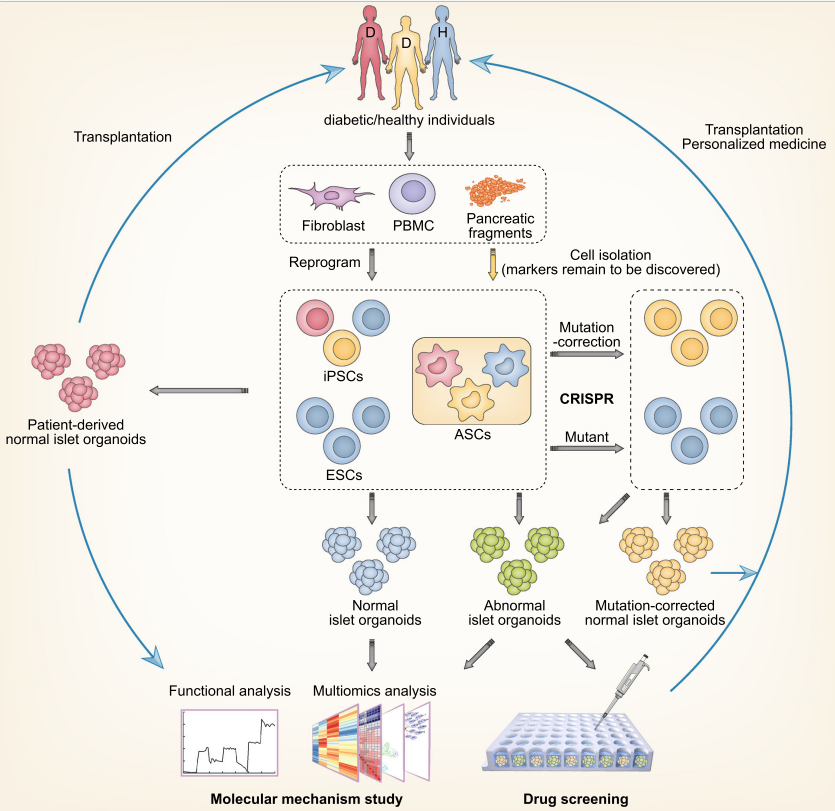
图 3. 胰岛样类器官在发育机制、疾病建模和个性化医疗中的应用前景【7】
参考文献
【1】Collombat, Patrick, et al. Embryonic endocrine pancreas and mature β cells acquire α and PP cell phenotypes upon Arx misexpression. The Journal of clinical investigation, 2007, 117.4: 961-970.
【2】Dolgin, Elie. Diabetes cell therapies take evasive action. Nature Biotechnol, 2022, 40: 291-295.
【3】Shankaran A, Prasad K, Chaudhari S, et al. Advances in development and application of human organoids. 3 Biotech, 2021, 11.6: 257.
【4】Ma, Xiaojie, et al. N 6-methyladenosine modification-mediated mRNA metabolism is essential for human pancreatic lineage specification and islet organogenesis. Nature Communications, 2022, 13.1: 4148.
【5】Zhu S, Russ H A, Wang X, et al. Human pancreatic beta-like cells converted from fibroblasts. Nature communications, 2016, 7.1: 10080.
【6】Choi H, Shinohara M, Ibuki M, et al. Differentiation of human-induced pluripotent stem cell-derived endocrine progenitors to islet-like cells using a dialysis suspension culture system. Cells, 2021, 10, 8: 2017.
【7】Zhang, Xiaofei, et al. Islet organoid as a promising model for diabetes. Protein & cell, 2022, 13.4: 239-257.
【8】Rosado-Olivieri E A, Aigha I I, Kenty J H, et al. Identification of a LIF-responsive, replication-competent subpopulation of human β cells. Cell Metabolism, 2020, 31(2): 327-338. e6.
【9】Zhu Z, Li Q V, Lee K, et al. Genome editing of lineage determinants in human pluripotent stem cells reveals mechanisms of pancreatic development and diabetes. Cell stem cell, 2016, 18.6: 755-768.