类器官培养 50 问-PDO 篇
dxy_r0meq856
Q11:对于病人的肿瘤组织,需要怎样处理尽量避免污染?
A11:1、将肿瘤组织置于 70%-75% 乙醇中 30 秒,清洗表面血块等杂物,并用剪刀对组织稍加修整。
2、放入含有青/链霉素、两性霉素 B、庆大霉素(单独使用某一种或几种组合)的PBS缓冲液进行进一步清洗。
3、原代细胞提取前,建议先进行支原体检测,防止支原体污染。
Q12:PDO 对于药敏反应的准确度是怎样的呢?
A12:有数据表明,PDO 对药敏反应的阳性预测值(预测某一特定药物有效)为 88%,阴性预测值(预测某一特定药物无效)为 100%,敏感性达 100%,特异性为 93%【1】。
Q13:病灶和癌旁培养出的类器官有差别吗?肿瘤组织的取材部位有什么要求?
A13:原发病灶和癌旁来源的肿瘤类器官是有差别的。
如:从形态上看,原发病灶来源的类器官比癌旁来源的类器官更具有侵袭性的结构【2】。
由于肿瘤具有异质性,因此类器官存在差异也是很常见的。如果想要尽量减小建模或药物筛选的误差,可以考虑多点位取材。
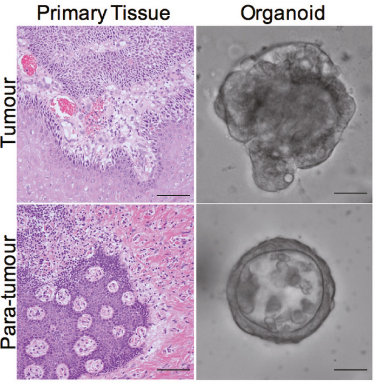
图1. 原发病灶来源的类器官比癌旁来源的类器官更具有侵袭性的结构【2】
Q14:PDO 培养的成功率是多少?成功率和是否进行治疗有关系吗?
A14:不同类型来源的 PDO 成功率略有不同,大部分的 PDO 培养成功率在 6%~70% 左右,通过缩短样本离体时间和操作步骤,可以适当提高成功率。如果在取样1个月以内有做过治疗,可能会降低培养成功率。
Q15:冻存多长时间内的组织可以用于类器官培养?
A15:对于冻存在 -80℃ 的组织,6 周之内复苏并进行类器官培养是最佳选择【4】。当然如果是保存在液氮中,保存的时间可以更久一些。
Q16:原代细胞提取时,通常会混有增殖非常迅速的成纤维细胞,应该怎样快速去除呢?
A16:成纤维细胞主要有两种去除方式:
1、鉴于成纤维细胞贴壁不牢的性质,可以采用反复贴壁的方式去除大部分成纤维细胞。
2、目前已有商用的成纤维细胞去除试剂,但是否会影响类器官的培养还需要实验验证。
Q17:培养肿瘤类器官需要原始肿瘤组织的大小是多少?活检样本量足够吗?
A17:手术组织大概需要 3 颗黄豆大小以上,穿刺活检样本需要至少3针,内镜活检至少钳取 6 颗以上。
Q18:从肿瘤组织中提取原代细胞后,发现细胞呈红色,这是为什么?
A18:红色主要是由于肿瘤组织中的大量红细胞所导致的。
首先,可以在拿到组织后尽量多清洗几次,能够去除大部分的红细胞;
其次,可以使用商品化的红细胞裂解液。红细胞裂解液的原理是去除无核细胞,因此不会影响其他有核细胞的正常培养。
Q19:怎样构建含有 PDO 的肿瘤微环境?
A19:目前构建含有 PDO 的肿瘤微环境主要有三种方式:
(I)将肿瘤组织经过物理或酶解分离后,在细胞外基质(Matrigel 或 BME)中进行类器官培养;同时分离外源性免疫细胞(通常来源于自体外周血或肿瘤组织),随后与生长的类器官进行共培养。
(II)将肿瘤消化后形成的球状组织与胶原蛋白混合,并接种到微流体培养装置中,即肿瘤细胞与样本中的固有免疫微环境共同培养,形成天然 TME 模型。
(III)将含有免疫细胞的肿瘤组织物理切割成组织碎片,在包被胶原蛋白凝胶的 transwell 小室中进行培养。凝胶的顶部暴露在空气中,同时外皿中的培养基通过可渗透的 transwell 扩散到内皿中,形成气-液交互界面(air–liquid interface, ALI)。
Q20:由于取到的肿瘤组织太小了,培养的类器官数目不足以进行后续的检测。我可以将类器官传代扩增吗?
A20:对于肿瘤来源的类器官一般是不建议传代的,因为传代后的表型会和体内情况略有差异。文献中的 PDO 一般会控制在 2-3代【4】,最多不超过 5 代【5】。
如果细胞数目太少,传代 5 次依然不能满足测试需求,可以考虑将检测的方式改变一下,比如从 96 孔板换成 384 孔板,甚至更小体系的微流控芯片。
Q21:肿瘤组织中会存在正常细胞吗?怎么去除这些正常细胞?
A21:即使是肉眼判断为肿瘤的组织中,也会混有一部分正常细胞。因此在进行类器官培养前,可以先将原代细胞进行流式分选或磁珠分选,得到肿瘤细胞再进行类器官培养。
Q22:正常细胞是否也会生长为类器官?肿瘤类器官培养时怎么去除正常类器官?
A22:由于肿瘤组织中通常混有一些健康细胞,因此培养出的肿瘤类器官很有可能混杂了来源于正常上皮的类器官。为了得到更纯的 PDO,除了 Q1 中提到的对原代细胞进行处理外,也可以对类器官群进行“纯化”,主要有一下三种途径【6】。
1、利用正常类器官和 PDO 的形态不同,在镜下进行手动筛选。图 1 展示了胃类器官和肿瘤类器官的形态差异:正常的胃类器官呈球形,由单层上皮细胞组成,具有较大的管腔;而肿瘤类器官通常是囊状,且有多层细胞形态。
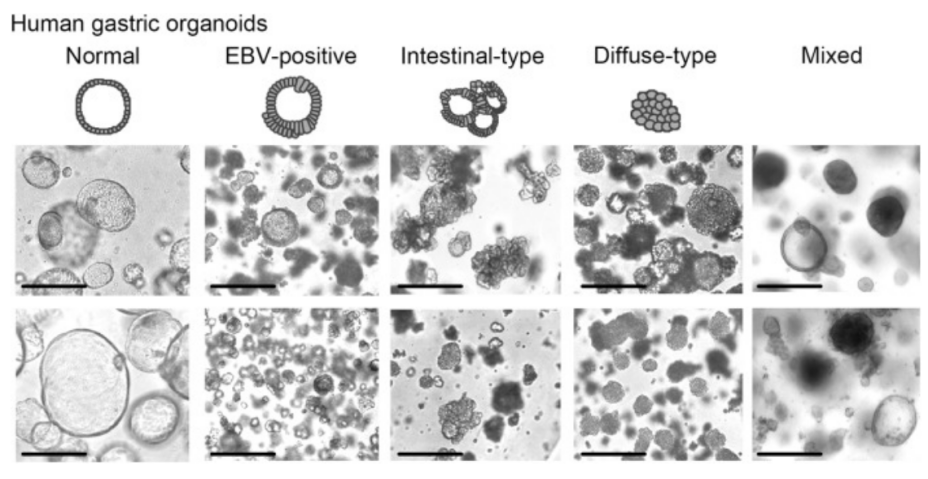
图 1. 正常胃类器官和肿瘤类器官的镜下形态不同,比例尺 300 μm【6】
2、通过调节培养基中的组分进行筛选。如:大多数胃癌表现出 TP53 突变,这一突变使 PDO 表现出对 Nutlin-3 更耐受,而正常类器官则会死亡。
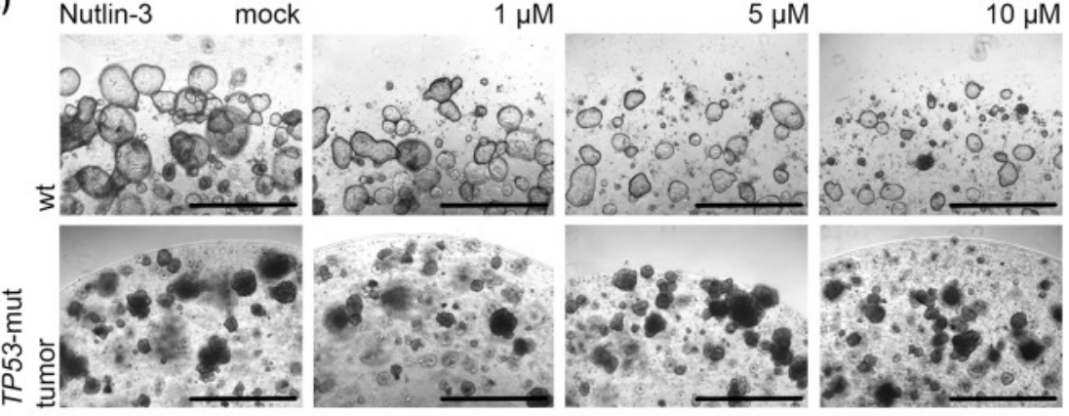
图 2. TP53 突变的类器官对 Nutlin-3 更耐受,比例尺 1mm【6】
3、将类器官消化为单个细胞后,流式分选出肿瘤细胞。
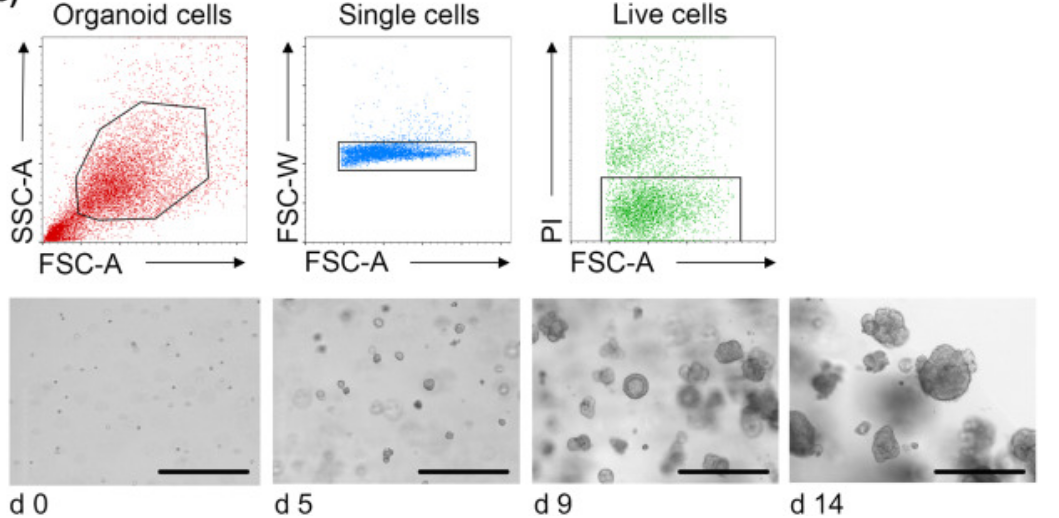
图3. 肿瘤类器官的单细胞流式分选,比例尺 400 μm【6】
Q23:进行药敏实验时,需要将 PDO 从基质胶中消化下来吗?
A23:可能有很多小伙伴担心基质胶会阻碍药物进入到 PDO 中,但无数实验已经证明,基质胶内的 PDO 是可以对药物进行响应的;而且 PDO 需要三维结构才能模拟体内状况,如果没有了基质胶的支撑,药敏实验的准确性会打折扣。
Q24:PDO 实验可以代替动物模型(PDX)吗?
A24:PDO 相较于动物模型有很多优点,例如成本低、耗时短、可以进行大规模培养和实验等。不过在药物代谢、癌症的浸润、转移等方向的研究则需要动物实验来进行。
Q25:在培养过程中,PDO 生长情况与之前相比异常,主要表现为生长周期变短,增殖迅速,这是什么原因?
A25:如果 PDO 在培养过程中突然增殖迅速,可能是某些杂质细胞(如成纤维细胞)的大量生长导致的,此时最好进行切片染色,观察一下是否存在这些细胞的污染。如果不是这个原因,则考虑是突变引起的,最好进行测序验证并与初代 PDO 进行比对。
Q26:怎样检测 PDO 对药物的敏感性?
A26:主要有两种途径进行检测。
1、进行细胞活力检测,即线粒体呼吸(耗氧率)、糖酵解 (H+浓度)等;
2、可以通过高内涵成像技术进行分析。
Q27:PDO 和肿瘤原代细胞的药敏实验浓度范围相同吗?
A27:小编查阅了大量的相关文献,发现 PDO 的药物测试有效浓度会整体高于 2D 细胞,不同种类的 PDO 之间也存在很大的倍数差异。
Q28:PDO 模型可以进行抗体类药物筛选吗?
A28:由于抗体类药物需要免疫细胞的参与,因此单纯的 PDO 模型并不适合。可以考虑在 PDO 的基础上建立肿瘤微环境(TME),从而进行抗体类药物的测试。
Q29:肿瘤细胞系(如 Hela 细胞系)可以培养成为 PDO 吗?
A29:不可以。PDO 需要依赖多种细胞在体外的自组装形成,而肿瘤细胞系没有自组装的能力,可能会形成细胞团,但这并不是 PDO。
Q30:PDO 可以进行建库吗?
A10:不论是原发型还是转移型肿瘤,都可以建立 PDO 样本库。但考虑到 PDO 的培养并不是百分之百成功的(比如 CRC-PDO 的培养成功率大约是 73%【7】),因此建库所需的样本量会比较大。
参考文献
【1】Vlachogiannis, G. et al.(2018). Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science, 359(6378), 920-926.
【2】Chen, X. et al.(2021). Phenotype transition of fibroblasts incorporated into patient‐derived oral carcinoma organoids. Oral Diseases.
【3】Ooft, S. N. et al.(2019). Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science translational medicine, 11(513), eaay2574.
【4】Mullins, C. S. et al. (2013). Establishment and characterization of primary glioblastoma cell lines from fresh and frozen material: a detailed comparison. PloS one, 8(8), e71070.
【5】Vogel, T. W. et al.(2005). Proteins and protein pattern differences between glioma cell lines and glioblastoma multiforme. Clinical cancer research, 11(10), 3624-3632.
【6】Wallaschek N. et al. Establishing pure cancer organoid cultures: identification, selection and verification of cancer phenotypes and genotypes[J]. Journal of molecular biology, 2019, 431(15): 2884-2893.
【7】HERPERS, Bram, et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR× LGR5 bispecific antibody with efficacy in epithelial tumors. Nature Cancer, 2022, 1-19.
6 个回答
龙大人驾到
处理病人的肿瘤组织以避免污染是非常重要的,以确保实验结果的准确性和可靠性。以下是一些建议的处理步骤:
佩戴个人防护装备:在处理肿瘤组织之前,确保佩戴适当的个人防护装备,包括实验室外套、手套、护目镜和口罩。这可以防止您自己受到组织样本的污染,并保护您免受潜在的病理学风险。
无菌操作条件:在处理肿瘤组织时,确保在无菌操作条件下进行操作。使用无菌工作台或无菌环境下的实验室设备,以减少外部污染的风险。
清洁工作区域:在开始操作之前,清洁工作区域,并确保使用消毒剂彻底清洁操作台、仪器和工具。
使用一次性器具:尽量使用一次性器具,如一次性刀片、注射器和移液器。这样可以避免交叉污染,减少清洗和消毒的需要。
分开处理样本:在处理不同的肿瘤样本时,确保将它们分开处理,避免交叉污染。使用不同的工具和容器,或在每个样本处理之间进行适当的清洗和消毒。
防止气溶胶形成:在处理肿瘤组织时,避免产生气溶胶,例如切割或搅拌样本时。这可以通过采取适当的技术和措施来实现,如使用封闭式系统或进行低速离心。
废弃物处理:将处理完的肿瘤组织、器具和废弃物放入专门的生物危险废弃物容器中,并按照相关的生物危险废弃物处理规定进行处理。
飞跃迷雾1
对于这20个问题,你又给予了很好的回答,再次感谢分享
sswei
人工智能全都回答了,不用修改全都正确。
feixue7758527w
写的很全面的,来学习一下,保留备存的。
高山云初
问题都是有答案的,感谢科普与分享
土井挞克树
快速置于70%-75%的酒精可以避免污染
相关产品推荐
相关问答