类器官培养与应用——垂体瘤类器官
近岸蛋白
人垂体肿瘤(human pituitary tumors, HPA)起源于垂体前叶的内分泌细胞,约占所有颅内肿瘤的 15%,通常被认为是良性肿瘤。然而在手术治疗中发现,30-40% 病例发生了局部的侵袭性行为【1】。垂体瘤分为功能性垂体瘤和无功能性垂体瘤,根据瘤细胞分泌的激素将功能性垂体瘤再进一步分为:泌乳素细胞腺瘤(PRL),生长激素细胞腺瘤(GH),促肾上腺皮质激素细胞瘤(ACTH),促甲状腺素细胞瘤(TSH),促性腺激素细胞瘤(LH/FSH)及混合瘤和未分类腺瘤。
目前,侵袭性垂体肿瘤的初步治疗方法是手术或放疗,标准药物治疗通常对肿瘤发展没有作用,但可以长期维持稳态,部分患者甚至可以达到抑制激素高分泌的效果。在标准治疗无效的情况下,唯一正式推荐的治疗方法‘替莫唑胺’仅对三分之一的患者有效。在这个精准医疗时代,迫切需要针对不同类型垂体瘤的治疗方法,为每个患者量身定制有效的治疗方案。类器官因其具有扩增传代潜力、能够复制器官/组织关键生物学特性、可以反应出药物有效程度等特点,正在成为体外药物筛选的重要工具。
本篇文章基于 Cells 【2】、和 Endocrine-Related Cancer【3】中的两篇文章,整理了人垂体瘤组织来源的类器官培养方案。
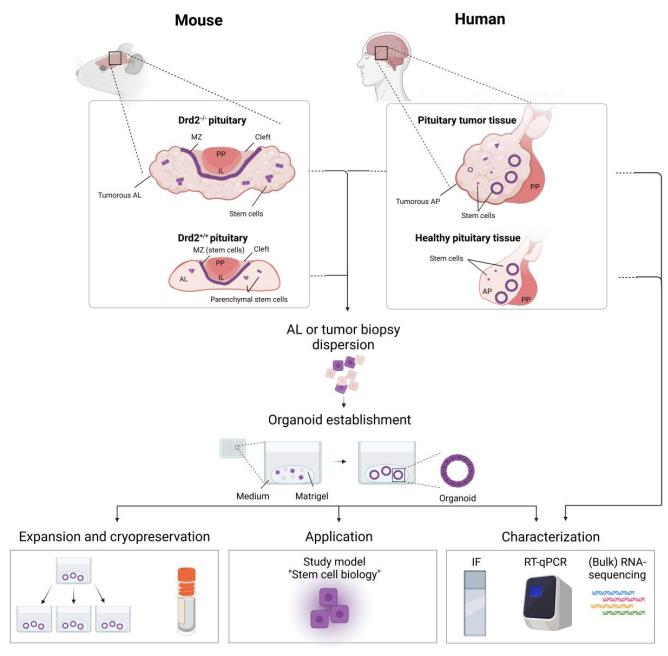
图 1. 垂体/垂体瘤类器官研究方案【3】
细胞来源
垂体瘤活检样本或手术样本
培养基配方
|
组织保存液 |
组织解离液I |
组织解离液II |
类器官培养基 |
近岸蛋白产品货号 |
|
|
基础培养基 |
Serum-Free Defined Medium (SFDM) |
DMEM/F12 |
- |
Serum-Free Defined Medium (SFDM) |
- |
|
Y27632 |
10 µM |
- |
- |
10mM |
- |
|
Glutamax |
2 mM |
- |
- |
2 mM |
- |
|
A83-01 |
0.5mM |
- |
- |
0.5 µM |
- |
|
Penicillin/streptavidin |
1% |
- |
- |
- |
- |
|
Kanamycin |
1% |
- |
- |
- |
- |
|
Amphotericin/gentamycin |
0.2% |
- |
- |
- |
- |
|
CHIR-98014 |
4mM |
- |
- |
- |
- |
|
Thiazovivin |
2.5mM |
- |
- |
- |
- |
|
Collagenase II |
- |
0.4% |
- |
- |
- |
|
Hyaluronic acid |
- |
0.1% |
- |
- |
- |
|
Trypsin-EDTA |
- |
0.03% |
- |
- |
- |
|
Accutase |
|
|
1× |
|
- |
|
B27 |
- |
- |
- |
2% |
- |
|
N2 |
- |
- |
- |
1% |
- |
|
Primocin |
- |
- |
- |
1x |
- |
|
N-acetyl-l-cysteine |
- |
- |
- |
1.25 mM |
- |
|
Nicotinamide |
- |
- |
- |
10 mM |
- |
|
SB431542 |
- |
- |
- |
10 µM |
- |
|
EGF |
- |
- |
- |
50 ng/mL |
C029 |
|
IGF-1 |
- |
- |
- |
100 ng/mL |
C023 |
|
WNT-3A |
- |
- |
- |
100 ng/mL |
C22R |
|
Rspondin-1 |
- |
- |
- |
500 ng/mL |
CX83 |
|
FGF-2 |
- |
- |
- |
20 ng/mL |
C779 |
|
FGF-8b |
- |
- |
- |
200 ng/mL |
C798 |
|
FGF-10 |
- |
- |
- |
100 ng/mL |
CR11 |
|
FGF-18 |
- |
- |
- |
10 ng/mL |
- |
|
SHH |
- |
- |
- |
30 ng/mL |
C100/C089 |
|
Noggin |
- |
- |
- |
100 ng/mL |
CB89 |
组织处理
1、将新鲜垂体瘤组织样本放入预冷的 D-PBS 中,剔除坏死的肿瘤组织,只选取活的肿瘤组织。
2、将垂体瘤组织转移到含有 5 mL 预冷的 D-PBS 溶液中清洗,去除血液和碎片。为防止污染,需要多次重复此步骤至液体变澄清。
3、吸出 D-PBS,将组织切割为 1–2 mm3 的小块,此步骤可以留存适量组织用于测序、免疫组化分析等。
4、将剩余组织块切碎,转移到含有 5 ml 组织解离液的离心管中,轻轻震荡混匀后,放置于 37℃ 培养箱中解离 5-10min,解离期间轻轻震荡或吹打混匀。然后将组织转移至含有 5ml 组织解离液II的离心管中,放置于 37℃ 培养箱中继续解离 5min。
5、解离后的组织用 D-PBS 清洗 2 次后,将悬浮液经过 70μm 细胞筛网过滤,收集解离的细胞。
6、将过滤的细胞悬液在 4℃ 条件下 400g 离心 5min,收集细胞沉淀。
7、若细胞沉淀有明显的红色,则将细胞重悬于 5ml 的红细胞裂解液中,冰上孵育 10min 使红细胞裂解。
8、向细胞悬液中加入 5ml DMEM / F12 冲洗细胞一次,离心收集细胞沉淀后,加入 1-2ml DMEM / F12 重悬细胞,并进行台盼蓝染色和细胞计数。
类器官培养
9、将冻存的 Matrigel 在 4℃ 下过夜解冻,在冰上以 3:1 的体积比将 Matrigel 与细胞悬液混合,轻轻吹打混匀避免产生气泡。
10、从 37℃ 培养箱中取出预热的 24 孔板,将 80μl 混合液接种在各孔中,注意需接种在孔的中心,避免接触侧壁。
11、将 24 孔板室温放置 5min 后,转移至 37℃,5%CO2 的培养箱中孵育 10min,使 Matrigel 固化。
12、向每个孔中缓慢滴加 500μl 预热的类器官培养基,确保基质胶被完全覆盖。放于 37℃,5%CO2 的培养箱中培养,每 2-3 天更换培养基。在类器官培养 15 天后可以考虑传代。
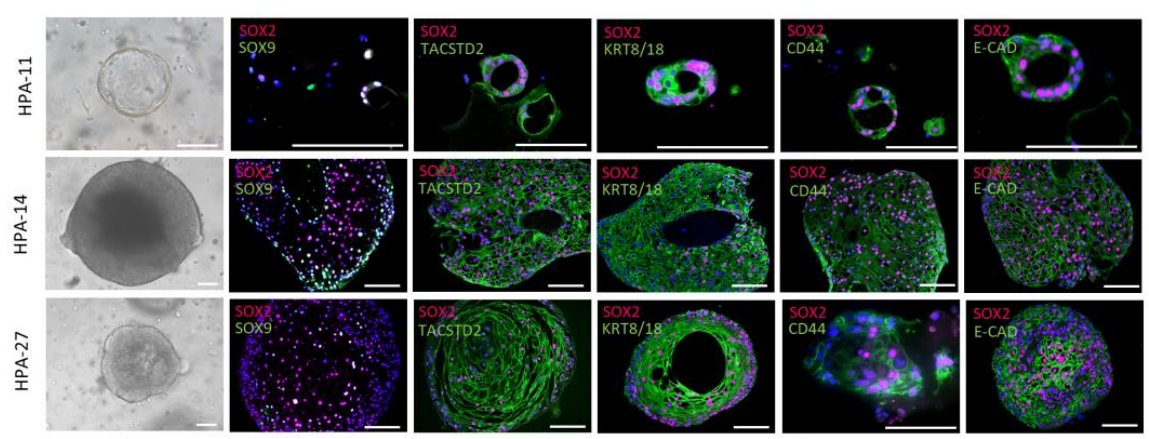
图 2. 显微镜下不同患者来源的 HPA 类器官形态及 SOX2、SOX9、TACSTD2、KRT8/18、CD55、E-CAD 标记物的表达均有不同程度的差异【3】
垂体(瘤)类器官模型的建立方式
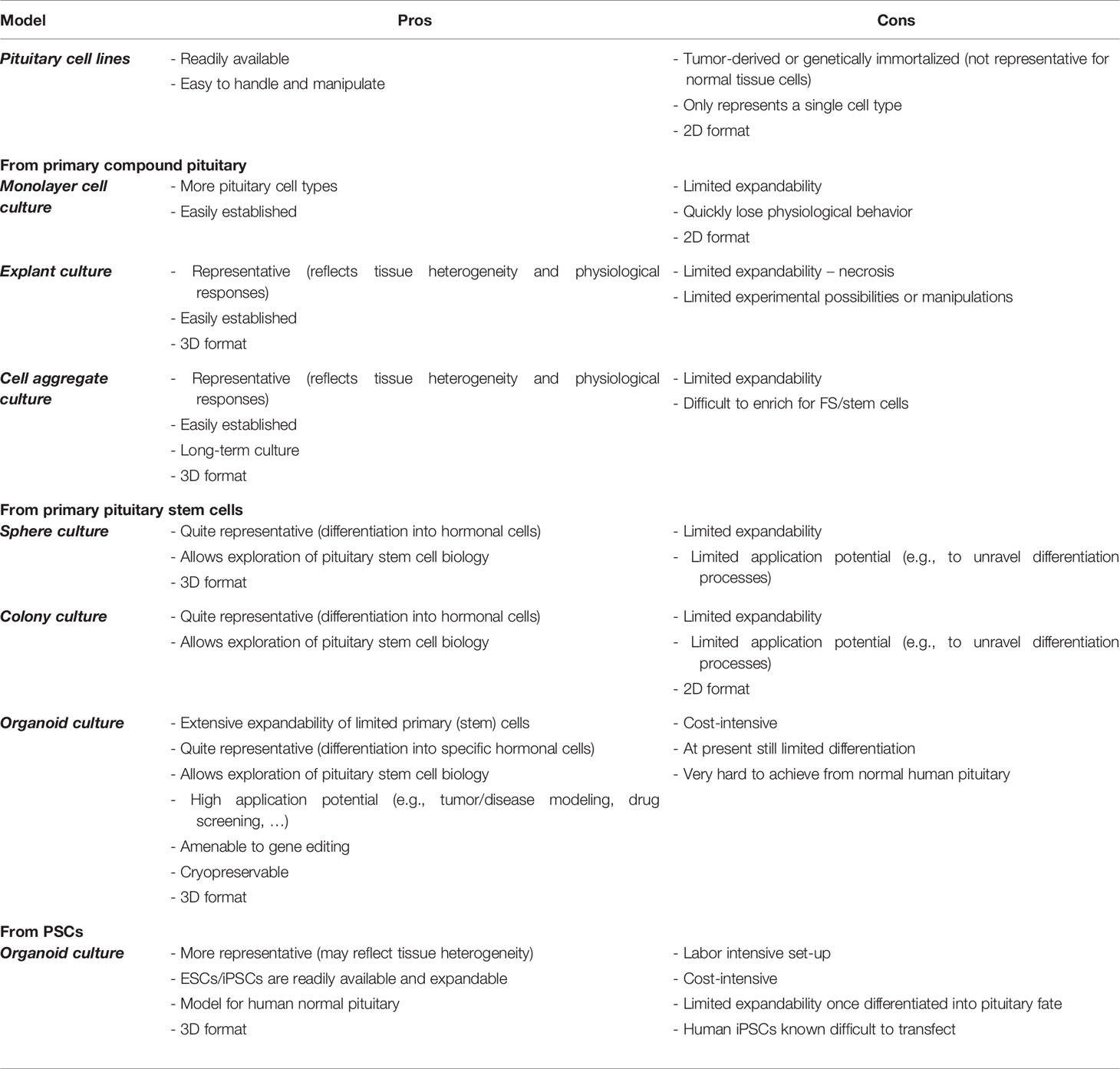
垂体(瘤)体外模型有很多种,其中作为 3D 模型的垂体(瘤)类器官通常是由 PSCs 或垂体干细胞衍生而来的,这两种不同来源的类器官作为研究垂体生物学的工具,各自具有优点和特定的应用范围(表 1)。垂体干细胞衍生的类器官模型最适合于研究出生后垂体干细胞生物学,包括表型、调节和激活分子网络的深入表征。然而,获得人类正常垂体组织是非常困难的,相比之下,人垂体瘤样本更容易从外科手术中获得,进而培养成肿瘤类器官模型;而 PSCs 衍生的技术更适合于开发遗传疾病模型【4】。
表 1.体外垂体研究模型的利弊分析【4】
参考文献
【1】Lasolle H, Vasiljevic A, Jouanneau E, et al. Aggressive corticotroph tumors and carcinomas[J]. Journal of Neuroendocrinology, 2022, 34(8): e13169.
【2】Chakrabarti J, Pandey R, Churko J M, et al. Development of Human Pituitary Neuroendocrine Tumor Organoids to Facilitate Effective Targeted Treatments of Cushing’s Disease[J]. Cells, 2022, 11(21): 3344.
【3】Nys C, Lee Y L, Roose H, et al. Exploring stem cell biology in pituitary tumors and derived organoids[J]. Endocrine-Related Cancer, 2022, 29(7): 427-450.
【4】Laporte E, Vennekens A, Vankelecom H. Pituitary remodeling throughout life: Are resident stem cells involved?[J]. Frontiers in Endocrinology, 2021: 1031.