类器官培养与应用——结直肠类器官
近岸蛋白
结直肠癌(Colorectal Cancer, CRC)是全世界最常见的癌症之一。在过去的十年中,预防性筛查项目的推广使死亡率大幅下降,然而在许多国家范围内,结直肠癌仍然是癌症相关死亡的第二大原因【1】。
几十年来,癌细胞系和基因编辑小鼠【2】一直是 CRC 研究的主要模型,人类肿瘤患者衍生异种移植(PDX)也已成为了 CRC 研究的工具【3】。与此同时,能够在体外进行长期培养的原发性/转移性 CRC 类器官模型进一步扩大了研究人员的选择范围。类器官既可以像 PDX 一样代表了个体患者的真实肿瘤情况,又兼具了细胞系的可传代、易于高通量筛选等特性。因此,CRC 类器官模型正在广泛应用于药物研究、个性化医疗等领域。
本篇文章基于 Nature Chemical Biology【4】、STAR protocols【5】、Nature protocols【6】和 Cell【7】发表的四篇文章,整理了人类结直肠癌组织来源的类器官培养方案。
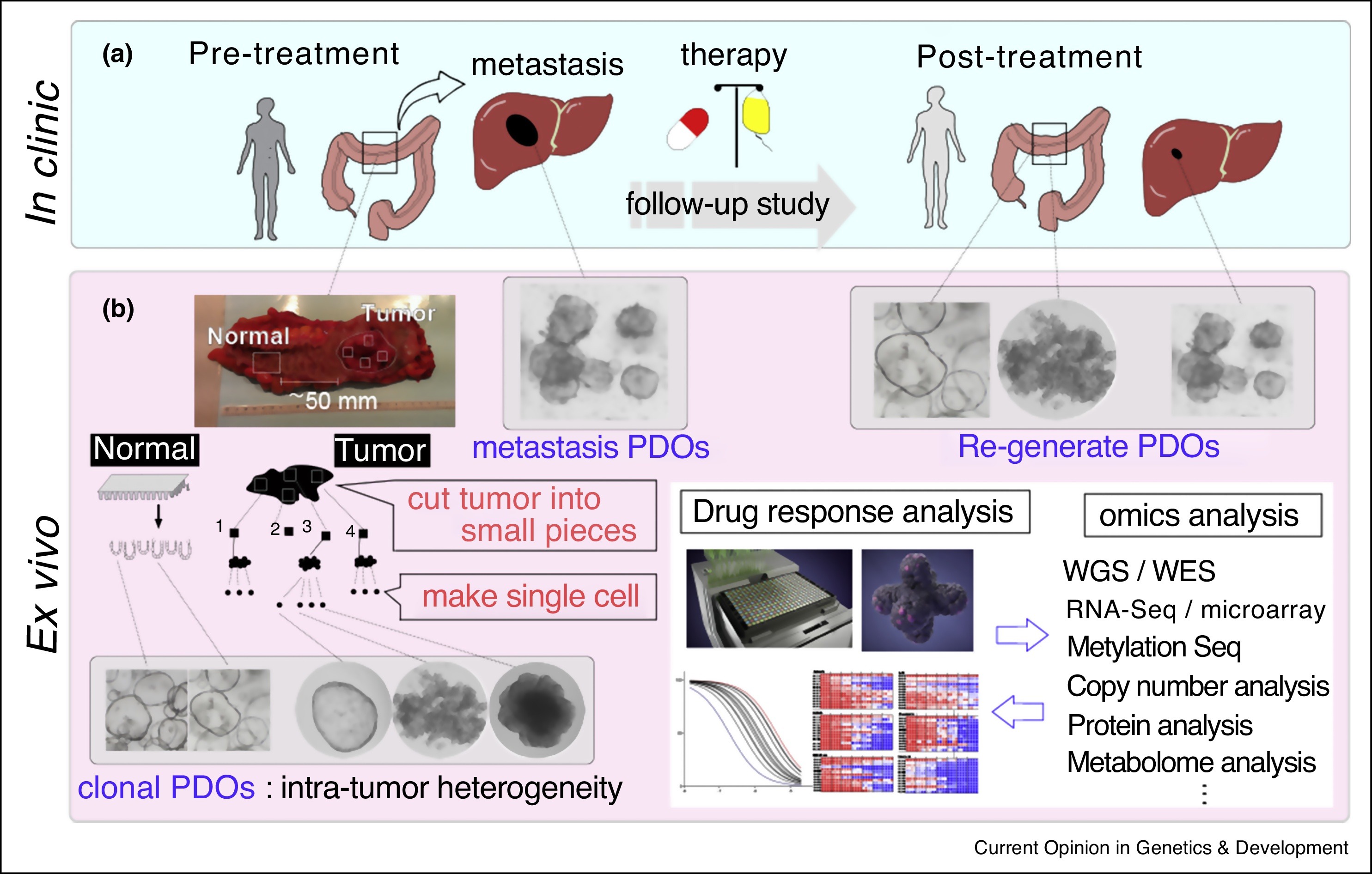
图 1. 病人组织来源的 CRC 类器官研究方案【8】
细胞来源
活检样本或手术样本
培养基配方
|
解离培养基 |
类器官培养基 |
红细胞裂解液 |
细胞冻存液 |
近岸蛋白产品货号 |
|
|
基础培养基 |
DMEM/F12 |
DMEM/F12 |
- |
60%类器官培养基 |
|
|
Penicillin-Streptomycin |
- |
1% |
- |
- |
|
|
FBS |
- |
- |
- |
- |
|
|
KnockOut Serum Replacement |
- |
- |
- |
30% |
|
|
Collagenase IV |
1mg/ml |
- |
- |
- |
|
|
RNase-Free DNase |
30 Kunitz Units |
- |
- |
- |
|
|
GlutaMAX |
- |
2mM |
- |
- |
|
|
Non-Essential Amino Acids |
- |
1× |
- |
- |
|
|
HEPES |
- |
10mM |
- |
- |
|
|
N2 |
- |
1× |
- |
- |
|
|
B27 |
- |
1× |
- |
- |
|
|
Heparin |
- |
4μg/ml |
- |
- |
|
|
EGF |
- |
20ng/ml |
- |
- |
C029 |
|
FGF basic |
- |
10ng/ml |
- |
- |
C046/C779 |
|
Noggin |
- |
100ng/ml |
- |
- |
CB89 |
|
R-spondin 1 |
- |
500ng/ml |
- |
- |
CX83 |
|
Y27632 |
- |
10μM |
- |
- |
|
|
SB202190 |
- |
3μM |
- |
- |
|
|
A83-01 |
- |
500nM |
- |
- |
|
|
N-acetyl-L-cysteine |
- |
1μM |
- |
- |
|
|
Nicotinamide |
- |
10mM |
- |
- |
|
|
Gastrin I |
- |
10nM |
- |
- |
|
|
氯化铵 |
- |
- |
0.8% |
- |
|
|
EDTA |
- |
- |
0.1mM |
- |
|
|
DMSO |
- |
- |
- |
10% |
组织处理
1、将新鲜 CRC 组织样本放入预冷的 PBS 中,剔除脂肪组织和坏死的肿瘤组织(通常为黄色或白色),只选取活的肿瘤组织(通常为粉红色)。
2、将 CRC 组织转移到含有 5 mL 预冷的 PBS 溶液中清洗,去除血液和碎片。为防止污染,需要多次重复此步骤至液体变澄清。
3、吸出 PBS,将组织切割为 1-2 mm3 的小块,此步骤可以留存适量组织用于测序、免疫组化分析等。
4、将剩余组织块切碎,并加入 1 ml 预冷的类器官培养基,用 p1000 吸头将肿瘤碎片悬浮液转移到含有 5 ml 解离培养基的离心管中,轻轻震荡混匀后,放置于 37℃ 培养箱中解离 1 h。每隔15min 轻轻震荡或吹打混匀一次。
5、加入 8ml 预冷的 DMEM/F12(含 10%FBS)终止消化。
6、将悬浮液经过 70μm 细胞筛网过滤,收集解离的细胞。
7、将过滤的细胞悬液在 4℃ 条件下 450g 离心 5min。
8、若细胞沉淀有明显的红色,则将细胞重悬于 5ml 的红细胞裂解液中,冰上孵育 10min 使红细胞裂解。
9、向细胞悬液中加入 5ml DMEM/F12 冲洗细胞一次,离心收集细胞沉淀后,加入 1-2ml DMEM/F12 重悬细胞,并进行台盼蓝染色和细胞计数。
类器官培养
10、将冻存的 Matrigel 在 4℃ 下过夜解冻,在冰上以 3:1 的体积比将 Matrigel 与细胞悬液混合,轻轻吹打混匀避免产生气泡。
11、从 37℃ 培养箱中取出预热的 24 孔板,将 80μl 混合液接种在各孔中,注意需接种在孔的中心,避免接触侧壁。
12、将 24 孔板室温放置 5min 后,转移至 37℃,5%CO2 的培养箱中孵育 10min,使 Matrigel 固化。
13、向每个孔中缓慢滴加 650μl 预热的类器官培养基,确保基质胶被完全覆盖。放于 37℃,5%CO2 的培养箱中培养,每 2-3 天更换培养基(用于换液的类器官培养基内不含 Y27632)。
类器官传代
14、吸出类器官培养液,机械分离 Matrigel,然后加入 500μl 胰蛋白酶,放置于 37℃ 培养箱中孵育 1-2min 后,用移液器多次吹打,从基质胶中释放类器官。
15、用含有 10%FBS 的 DMEM/F12 培养基终止消化,在 4℃ 条件下 300g 离心 5min。
16、用冷 PBS 清洗后,再次 4℃ 条件下 300g 离心 5min。
17、将所得沉淀按照 1:3-1:5 的比例重复 10-13 步骤(具体比例通过类器官的汇合度确定),完成传代。
类器官冻存
18、取 1-2 个孔的类器官,消化离心后取细胞沉淀,加入 1ml 细胞冻存液。
19、将细胞重悬后转移至冻存管中,利用程序降温盒缓慢降温至 -80℃。
20、第二天,将样品转移到液氮中长期储存。
类器官复苏
21、将液氮冻存的 CRC 类器官放置在 37℃ 水浴锅中进行解冻,水浴时间不宜超过 2min。
22、将细胞悬液转移至 15ml 离心管中,加入 10ml 预冷的 DMEM/F12 培养基(含10% FBS)。4℃ 条件下 300g 离心 5min,取细胞沉淀。
23、将所得沉淀重复 10-13 步骤,完成 CRC 类器官复苏。
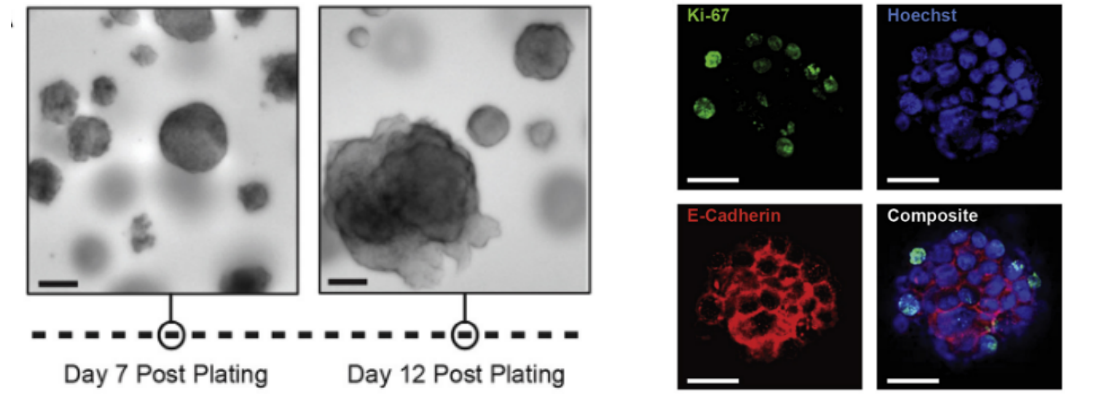
图 2. 显微镜下 CRC 类器官的形态,以及 Ki-67、E-Cadherin 标记物的表达【5】
利用类器官技术,能够将 CRC 和正常结直肠组织在体外进行长期扩增,并且在微卫星稳定(MSS)来源的 CRC 类器官中发现,类器官模型能够保留样本的遗传多样性和形态稳定性【9】。结直肠(癌)类器官的进一步优势包括可以进行建库、细胞异质性研究、实验动物移植、个体患者分析和基因编辑,目前已经成为了疾病建模的优秀工具,未来可能在再生医学领域大放异彩【10】。
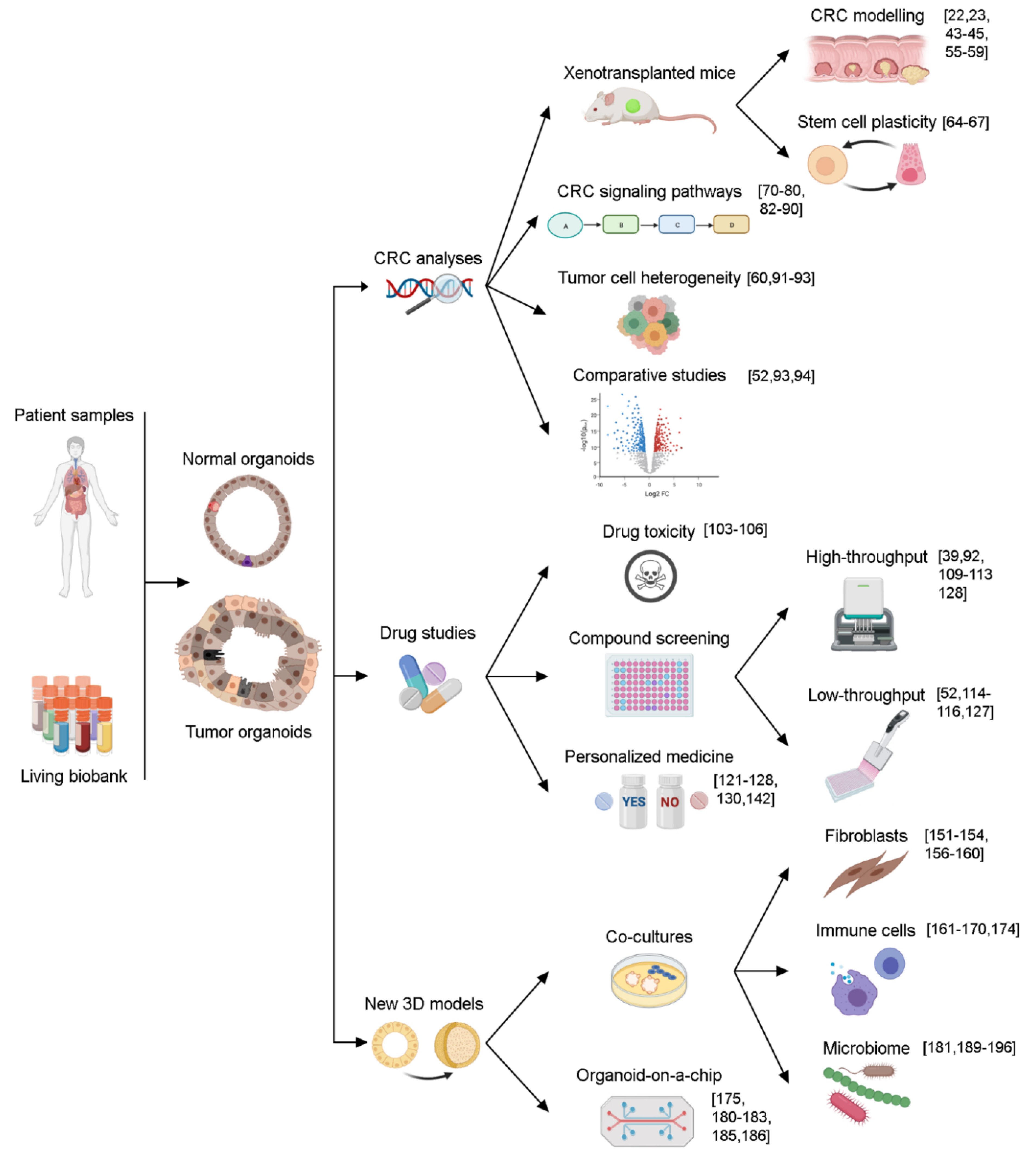
图 3.结直肠(癌)类器官在基础和临床研究中的应用【10】
参考文献
【1】TORRE, Lindsey A., et al. Global cancer statistics, 2012. CA: a cancer journal for clinicians, 2015, 65.2: 87-108.
【2】EVANS, Jonathan P., et al. From mice to men: Murine models of colorectal cancer for use in translational research. Critical reviews in oncology/hematology, 2016, 98: 94-105.
【3】BROWN, Kai M., et al. Patient-derived xenograft models of colorectal cancer in pre-clinical research: a systematic review. Oncotarget, 2016, 7.40: 66212.
【4】TOSHIMITSU, Kohta, et al. Organoid screening reveals epigenetic vulnerabilities in human colorectal cancer. Nature Chemical Biology, 2022, 18.6: 605-614.
【5】BERGIN, Christopher J., et al. Protocol for serial organoid formation assay using primary colorectal cancer tissues to evaluate cancer stem cell activity. STAR protocols, 2022, 3.1: 101218.
【6】FUMAGALLI, Arianna, et al. A surgical orthotopic organoid transplantation approach in mice to visualize and study colorectal cancer progression. Nature protocols, 2018, 13.2: 235-247.
【7】VAN DE WETERING, Marc, et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell, 2015, 161.4: 933-945.
【8】SASAKI, Nobuo, et al. Studying cellular heterogeneity and drug sensitivity in colorectal cancer using organoid technology. Current Opinion in Genetics & Development, 2018, 52: 117-122.
【9】BEHJATI, Sam, et al. Genome sequencing of normal cells reveals developmental lineages and mutational processes. Nature, 2014, 513.7518: 422-425.
【10】BARBÁCHANO, Antonio, et al. Organoids and colorectal cancer. Cancers, 2021, 13.11: 2657.