类器官培养与应用——卵巢癌类器官
近岸蛋白
卵巢癌(Ovarian Cancer)是最具破坏性的妇科癌症,目前 5 年总生存率低至 47%【1】。卵巢癌是一种高度异质性疾病,通常根据组织病理学、分子生物学和遗传学分析的结果,将卵巢癌分为两大类:I 型卵巢癌病情进展缓慢,主要为低级别浆液性癌(LGSC),粘液癌,子宫内膜样癌,透明细胞癌等;II 型癌症则进展迅速,主要为高级别浆液性癌(HGSC)、未分化癌和癌细胞瘤。
治疗卵巢癌的标准方式是手术切除和铂-紫杉醇化疗相结合,然而这类化疗方式往往对于透明细胞癌和粘液癌患者无效【2,3】;此外,初始化疗后通常会由于铂类耐药而复发,因此建立更精准的卵巢癌模型对于深入理解疾病机理和个性化治疗是必不可少的。基于类器官技术的 OC 类器官就是可以模拟来源组织关键特征的体外模型,不仅能够再现患者体内肿瘤的特异性(包括表型特性和基因突变),并能够检测患者对药物的敏感性。
本篇文章基于STAR protocol【4】发表的文章,整理了病人组织来源的卵巢癌类器官的培养方案。
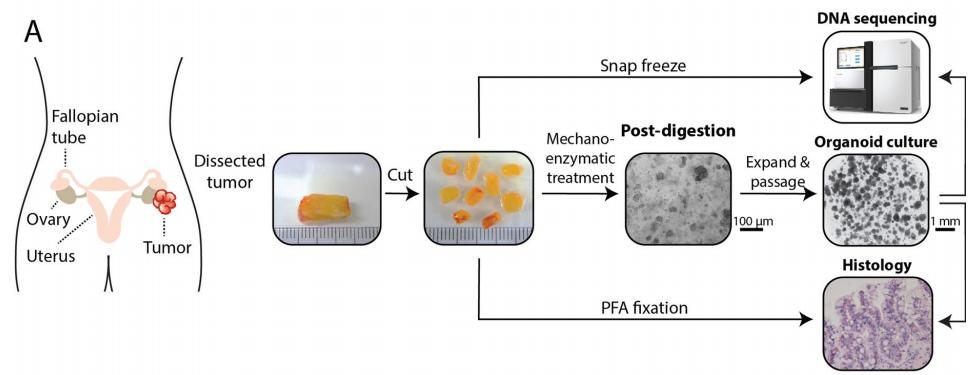
图 1. 病人组织来源的卵巢癌类器官培养方案【5】
细胞来源
活检样本或手术样本
培养基配方
|
取样培养基 |
解离培养基 |
OCO培养基 |
细胞冻存液 |
近岸蛋白产品货号 |
|
|
基础培养基 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
DMEM/F12 |
|
|
penicillin-streptomycin |
2% |
- |
1% |
- |
|
|
FBS |
10% |
- |
- |
30% |
|
|
Collagenase IV |
- |
1mg/ml |
- |
- |
|
|
L-glutamine |
- |
- |
1× |
- |
|
|
A83-01 |
- |
- |
0.25μM |
- |
|
|
Nicotinamide |
- |
- |
5mM |
- |
|
|
N2 |
- |
- |
1× |
- |
|
|
B27 |
- |
- |
1× |
- |
|
|
N-acetylcysteine |
- |
- |
1.25mM |
- |
|
|
17-β Estradiol |
- |
- |
10nM |
- |
|
|
p38i(SB203580) |
- |
- |
1μM |
- |
|
|
EGF |
- |
- |
50ng/ml |
- |
C029 |
|
Noggin |
- |
- |
100ng/ml |
- |
CB89 |
|
R-spondin 1 |
- |
- |
50ng/ml |
- |
CX83 |
|
IGF1 |
- |
- |
20ng/ml |
- |
C023 |
|
HGF |
- |
- |
10ng/ml |
- |
CJ72 |
|
NRG1 |
- |
- |
50ng/ml |
- |
C753 |
|
Y27632 |
- |
- |
10μM |
- |
|
|
DMSO |
- |
- |
- |
10% |
组织处理
1、将取样培养基中的组织转移到培养皿中,用 PBS 多次冲洗至液体变澄清。然后用无菌手术刀剔除脂肪及坏死组织。
2、将组织切割为 1–2 mm3 的小块,此步骤可以留存适量组织用于测序、免疫组化分析等。
3、将所有剩余的组织碎片收集到 30 ml 锥形管中,加入 8 ml 解离培养基,并在 37°C条件下解离 1-2h。每隔 20min,利用移液器机械吹打,促进解离。
4、向悬浮液中加入 50μl 脱氧核糖核酸酶(2mg / ml),并在 20°C-22°C 下孵育1min。
5、加入 8ml 预冷的 DMEM/F12(含 10%FBS)终止消化。
6、将悬浮液经过 70μm 细胞筛网过滤,收集解离的细胞。
7、将过滤的细胞悬液在 4℃ 条件下 220g 离心 5min。
8、用 1mlDMEM / F12(20°C-22°C)冲洗细胞一次,离心收集细胞沉淀后,加入500μl DMEM / F12(20°C-22°C)重悬细胞,并在细胞计数后,将细胞悬液调整浓度至 1,500 个细胞/μl。
类器官培养
9、将冻存的 Matrigel 在 4℃ 下过夜解冻,在冰上以 7:3 的体积比将 Matrigel 与细胞悬液混合,轻轻吹打混匀避免产生气泡。
10、从 37℃ 培养箱中取出预热的 48 孔板,将 20μl 混合液接种在各孔中,注意需接种在孔的中心,避免接触侧壁。
11、将 48 孔板倒置放入 37℃,5%CO2 的培养箱中孵育 10min,使 Matrigel 固化。
12、向每个孔中缓慢滴加 250μl 预热的 OCO (Ovarian Cancer Organoid) 培养基,确保基质胶被完全覆盖。放于 37℃,5%CO2 的培养箱中培养,每 2-3 天更换培养基(用于换液的 OCO 培养基内不含 Y27632)。
类器官传代
13、当直径达到约 200-300μm 时,将类器官按照 1:3-1:5 的比例进行传代(具体比例通过类器官的汇合度确定)
14、吸出孔内培养基,加入 400μl 预冷的 DMEM/F12 培养基,并用移液器多次吹打,从基质胶中释放类器官。如果将多个孔合并,则将 400μl 培养基从第一个孔转移到下一个孔(依此类推)。
15、将收集的类器官转移到 5 ml Eppendorf 管中并放在冰上,4℃ 条件下 220g 离心 5min。
16、去除离心上清,并添加 37℃ 预热的 TrypLE Express(含 10μM Y27632)。轻轻旋转 Eppendorf 管,使类器官与 TrypLEExpress 混合均匀。
17、37℃ 条件下将类器官与 TrypLE 孵育 10min(致密型类器官)或 5min(低粘性和囊性类器官)。
18、加入 500μl 预冷的 DMEM/F12 终止消化,4℃ 条件下 220g 离心 5min。
19、将类器官沉淀重悬于 700μl 预冷的 DMEM / F12中,使用移液器吹打数次,机械地破坏类器官。
20、将所得细胞悬液重复 8-12 步骤,完成传代。
类器官冻存
21、取 1-4 个孔的类器官,消化离心后取细胞沉淀,加入 1ml 细胞冻存液。
22、将细胞重悬后转移至冻存管中,利用程序降温盒缓慢降温至 -80℃。
23、第二天,将样品转移到液氮中长期储存。
类器官复苏
24、将液氮冻存的 OC 类器官放置在 37℃ 水浴锅中进行解冻,水浴时间不宜超过 2min。
25、将细胞悬液转移至 15ml 离心管中,加入 10ml 预冷的 DMEM/F12 培养基(含 10% FBS)。4℃ 条件下 220g 离心 5min,取细胞沉淀。
26、将所得细胞重复 8-12 步骤,完成 OC 类器官复苏。
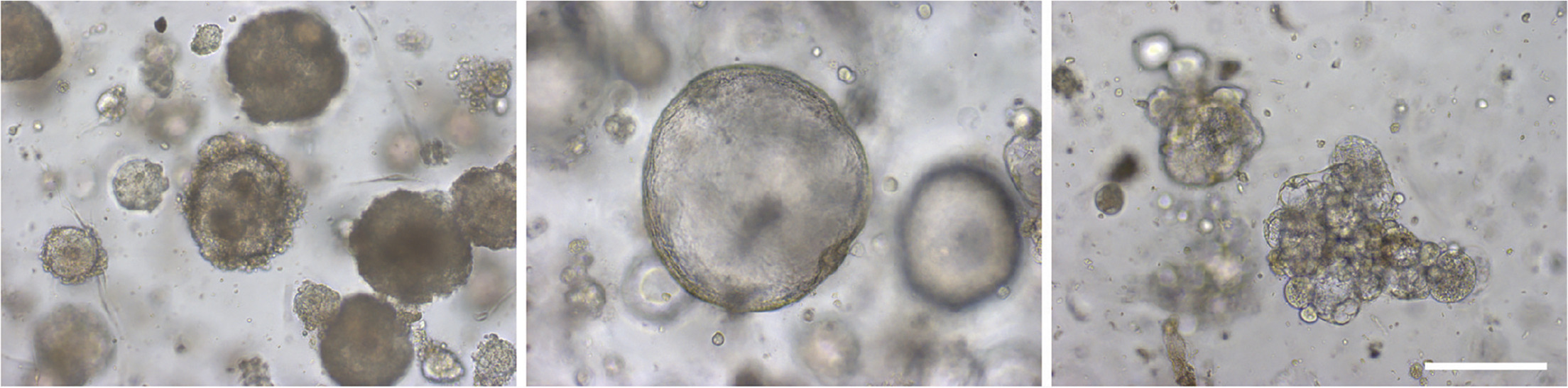
图 2. OC 类器官的不同形态表型。即致密(左),囊性(中)和低内聚(右)型 OC 类器官。比例尺 200 μm【4】。
卵巢癌类器官样本来源不局限于活检样本或手术样本,腹水和胸腔积液中的癌细胞也同样可以用于构建 OC 类器官。培养成功的 OC 类器官经过 DNA 修复的功能性分析,可以准确预测患者对 DNA 修复抑制剂的临床反应【6】。同时,OC 类器官也可以作为药物筛选的模型,通过分析个体患者来源的 OC 类器官对化疗药物敏感性的差异,来预测患者对特定药物的临床反应,从而选择针对患者的最佳治疗方案【7】。通过构建病人来源的 OC 类器官,对于更深入地了解卵巢癌的病因、发病机制、异质性和耐药性至关重要,并且对于确定新的治疗靶点和新药研发、患者用药决策方面都有着巨大的潜力。
参考文献
【1】Siegel R. L. et al. Cancer statistics, 2016[J]. CA: a cancer journal for clinicians, 2016, 66(1): 7-30.
【2】Pectasides D. et al. Advanced stage clear-cell epithelial ovarian cancer: the Hellenic Cooperative Oncology Group experience[J]. Gynecologic oncology, 2006, 102(2): 285-291.
【3】Hess V. et al. Mucinous epithelial ovarian cancer: a separate entity requiring specific treatment[J]. Journal of clinical oncology, 2004, 22(6): 1040-1044.
【4】Maenhoudt, N., & Vankelecom, H. (2021). Protocol for establishing organoids from human ovarian cancer biopsies. STAR protocols, 2(2), 100429.
【5】Kopper O. et al. An organoid platform for ovarian cancer captures intra-and interpatient heterogeneity[J]. Nature medicine, 2019, 25(5): 838-849.
【6】Hill S J. et al. Prediction of DNA Repair Inhibitor Response in Short-Term Patient-Derived Ovarian Cancer Organoids DNA Repair Profiling of HGSC Organoids[J]. Cancer discovery, 2018, 8(11): 1404-1421.
【7】Liu H D. et al. Organoid of ovarian cancer: genomic analysis and drug screening[J]. Clinical and Translational Oncology, 2020, 22(8): 1240-1251.