类器官培养与应用——血管类器官
近岸蛋白
血管是胚胎最先发育的器官之一,是所有其它器官功能的基础。
血管系统由两种细胞类型构成:内皮细胞 (Endothelial cells) 和壁细胞 (Mural cells),其中壁细胞是周细胞 (Pericytes, PC) 和血管平滑肌细胞 (Vascular smooth muscle cells, vSMCs) 的统称。
内皮细胞组成血管的内壁,是血管管腔内血液及其他血管壁 (单层鳞状上皮) 的接口;而壁细胞在保持血管壁的完整性方面起着关键作用【1】。
在发育过程中,在成纤维细胞生长因子 2 (FGF-2) 、骨形态发生蛋白 4 (BMP4) 和血管内皮生长因子 A (VEGF-A) 的刺激下,内皮细胞在中胚层祖细胞中产生,并组成原始管状网络。
随后,在血管生成的过程中,原有的神经丛进行重塑,新的血管发芽和分支,直到一个成熟的循环网络形成【2】。
本篇文章基于 Nature protocol【3】 发表的文章,整理了人类多能干细胞 (hPSCs) 来源的血管类器官培养方案。
培养过程遵循发育原理,依靠上述生长因子进行诱导分化,最终培养成为血管类器官网络。
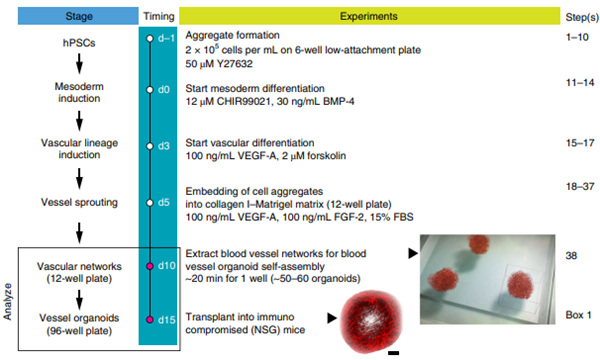
图1. hPSCs 来源的血管类器官培养方案【3】
细胞来源
hPSCs
培养试剂配方
|
|
hPSCs 培养基 |
中胚层分化培养基 |
中胚层分化培养基-2 |
StemPro-34 SFM 完全培养基 |
Collagen I 溶液 |
血管分化培养基 |
近岸蛋白产品货号 |
|
基础培养基 |
DMEM-F12 |
50%DMEM-F12 |
50%DMEM-F12 |
StemPro-34 SFM |
DMEM-F12 |
StemPro-34 SFM |
- |
|
|
50%Neuro basal |
50%Neuro basal |
- |
||||
|
penicillin-streptomycin |
1% |
1% |
1% |
1% |
- |
1% |
- |
|
FBS |
- |
- |
- |
- |
- |
15% |
- |
|
KnockOut Serum Replacement |
20% |
- |
- |
- |
- |
- |
- |
|
Glutamax |
1% |
0.5% |
0.5% |
1% |
0.5% |
1% |
- |
|
NEAAs |
1% |
- |
- |
- |
- |
- |
- |
|
2-mercaptoethanol |
0.007‰ |
0.007‰ |
0.007‰ |
- |
- |
- |
- |
|
Y-27632 |
50 μM |
- |
- |
- |
- |
- |
- |
|
N2 |
- |
1% |
1% |
- |
- |
- |
- |
|
B27 |
- |
2% |
2% |
- |
- |
- |
- |
|
CHIR99021 |
- |
12μM |
- |
- |
- |
- |
- |
|
BMP-4 |
- |
30 ng/ml |
- |
- |
- |
- |
在研 |
|
VEGF-A |
- |
- |
100 ng/ml |
- |
- |
100 ng/ml |
C083 |
|
FGF-2 |
- |
- |
- |
- |
- |
100 ng/ml |
C046 |
|
Forskolin |
- |
- |
2μM |
- |
- |
- |
- |
|
StemPro-34 nutrient supplement |
- |
- |
- |
2.6% |
- |
2.6% |
- |
|
Collagen |
- |
- |
- |
- |
1.6 mg/ml |
- |
- |
|
0.1N NaOH |
- |
- |
- |
- |
0.12% |
- |
- |
|
HEPES |
- |
- |
- |
- |
10% |
- |
- |
|
7.5% Sodium bicarbonate |
- |
- |
- |
- |
0.8% |
- |
- |
|
PureCol |
- |
- |
- |
- |
50% |
- |
- |
|
Matrigel |
- |
- |
- |
- |
20% |
- |
- |
hPSCs培养
1、将冻存的 Matrigel 在 4℃ 下过夜解冻,在 6 孔板的每孔滴加 1ml 冷的 Matrigel,旋动 6 孔板使 Matrigel 分布均匀。随后转移至 37℃ 条件下孵育 10min 使其凝固,使用前需室温静置 1h。
2、将 hPSCs 接种在包被 Matrigel 的 6 孔板中,每孔加入 3ml E8 培养基,放置在 37℃,5%CO2 的培养箱中,培养至细胞汇合度约为 75–85%、且大部分无分化的状态时,吸出培养基。
3、向 hPSCs 中加入 0.5 mM EDTA 洗涤细胞一次。
4、吸去 EDTA 溶液,每孔加入 0.6ml Accutase,并将培养皿放置在 37℃ 解离约 3-5min,直到所有的细胞变圆。
5、向每个孔中加入 5ml 的 hPSCs 培养基,并用 0.1% 台盼蓝进行染色计数。
6、将所有细胞转移至 15ml 离心管中,室温下 300g 离心 3min,收集沉淀细胞。6 孔板中每孔接种 2×105 个细胞,加入预热的 3ml hPSCs 培养基,放置在 37℃,5%CO2 培养箱中进行培养。
诱导中胚层分化
7、hPSCs 培养 1 天至形成具有平滑边界的聚集体,直径 >50-100 µm 。
8、聚集体形成后,将所有细胞转移至 15ml 离心管中,依靠重力自然沉降(注意:不建议将聚集体离心处理)。静置 15-20min 后,小心吸去培养基上清。
9、将聚集体用 10ml hPSCs 中胚层分化培养基轻轻重悬,加入到低吸附的 6 孔板中,每孔 3ml,放置在 37℃,5%CO2 培养箱中孵育 3 天以诱导中胚层分化,培养期间每天用1ml枪头吹打避免过度聚合。
10、重复步骤 8,将培养基替换为中胚层分化培养基-2,放置在 37℃,5%CO2 培养箱中孵育 2 天。
血管类器官形成
11、将冻存的 Matrigel 在 4℃ 下过夜解冻,在 12 孔板中每孔铺 0.5ml 第一层胶原(1.5mg/ml collagen I+ 25% Matrigel),轻轻旋转孔板使溶液分布均匀。
12、将 12 孔板放置在 37℃ 条件下固化 2 小时。
13、按照步骤 8 收取细胞沉淀,加入 1ml StemPro-34 SFM 完全培养基清洗细胞一次。
14、计算聚集体的数量,将聚集体用 Collagen I 溶液重悬并置于冰上,调整聚集体的密度为 40-60 个细胞团/50μl。
15、从培养箱中取出含有第一层胶原的 12 孔板,并小心地向 12 孔板的每个孔中添加 0.5 mL含细胞聚集体的 Collagen I溶液。前后晃动平板,使细胞均匀地分布在孔内。
16、将 12 孔板放置在 37℃ 条件下固化 2h。
17、加入预热的 3ml 血管分化培养基,放置在 37℃,5%CO2 培养箱中进行培养。血管芽会在培养的 1-3 天出现。培养 3天后换液,之后每隔一天换液一次。
18、大约 10 天后可以将血管类器官固定染色或采用其它方案进行下一步分析。
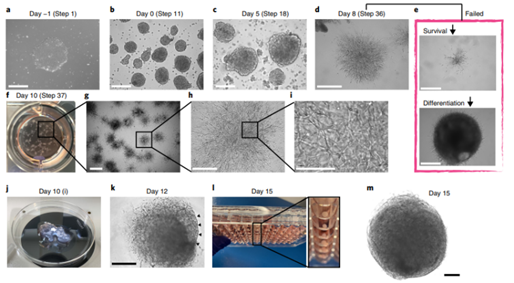
图 2. 血管类器官的形态【3】
血管类器官的应用前景
血管是血液运输营养物质和氧气的管道,对维持组织和器官的稳态有着重要的作用。目前已知有多种疾病与血管异常有关。
在成年人中,血管功能障碍与中风【4】、心脏病【5】、糖尿病【6】、动脉粥样硬化【7】、癌症【8】等主要疾病息息相关。
其次,类器官技术虽然已经日趋成熟,但仍有一些限制阻碍了其更广泛的应用。
目前 3D 培养中的类器官仅依靠被动扩散来交换营养物质、氧气和代谢废物,然而扩散的有效距离通常不超过 300μm,这也导致类器官的中心常常发生坏死。
通过将类器官与血管系统共同培养,可以显著地增加类器官的尺寸和寿命【9】,图 3 列举了类器官血管化的方案。
我们设想,当类器官血管化这一技术成熟时,它将成为类器官技术应用进一步扩大的宝贵工具。

图 3. 类器官血管化的方案【10】
参考文献
【1】Ono, S., & Kabashima, K. Skin Immune System: Microanatomy. 2016, 443-452.
【2】Ferguson III J E, Kelley R W, Patterson C. Mechanisms of endothelial differentiation in embryonic vasculogenesis[J]. Arteriosclerosis, thrombosis, and vascular biology, 2005, 25(11): 2246-2254.
【3】Wimmer R A, Leopoldi A, Aichinger M, et al. Generation of blood vessel organoids from human pluripotent stem cells[J]. Nature protocols, 2019, 14(11): 3082-3100.
【4】Sommer C J. Ischemic stroke: experimental models and reality[J]. Acta neuropathologica, 2017, 133(2): 245-261.
【5】Lu L, Liu M, Sun R R, et al. Myocardial infarction: symptoms and treatments[J]. Cell biochemistry and biophysics, 2015, 72(3): 865-867.
【6】Liu S Q, Fung Y C. Changes in the rheological properties of blood vessel tissue remodeling in the course of development of diabetes[J]. Biorheology, 1992, 29(5-6): 443-457.
【7】Basatemur G L, Jørgensen H F, Clarke M C H, et al. Vascular smooth muscle cells in atherosclerosis[J]. Nature reviews cardiology, 2019, 16(12): 727-744.
【8】Zhang Y, Wang S, Dudley A C. Models and molecular mechanisms of blood vessel co-option by cancer cells[J]. Angiogenesis, 2020, 23(1): 17-25.
【9】Salzmann M, Schmid D, Geiger M. Regulation of Tissue Perfusion and Exchange of Solutes, Macromolecules, and Water Between Blood Vessels and the Interstitial Space[M]//Fundamentals of Vascular Biology. Springer, Cham, 2019: 65-80.
【10】Zhang S, Wan Z, Kamm R D. Vascularized organoids on a chip: Strategies for engineering organoids with functional vasculature[J]. Lab on a Chip, 2021, 21(3): 473-488.