类器官培养与应用——心脏类器官
近岸蛋白
心脏是哺乳动物最先形成的器官之一,这使得它极易受到内在和外在疾病因素的影响。
心肌细胞的分化受转录途径的调节,产生不同的心肌细胞群,例如窦房结细胞、房室细胞、心房细胞、心室细胞和浦肯野细胞。
每个群都与特定的心脏疾病相关,因此可以通过类器官对相关疾病进行建模。3D 培养心脏类器官(human cardiac organoids,hCOs)由于具有更复杂的结构和更多样的细胞类型,正在逐步成为更适用于研究心脏发育、物测试的体外模型。
本篇文章基于 Nature Biotechnology【1】,Stem cells and development【2】、Development【3】、Current Protocols in Stem Cell Biology【4】发表的四篇文章,整理了人类胚胎干细胞(human ESCs)来源的心脏类器官培养方案。
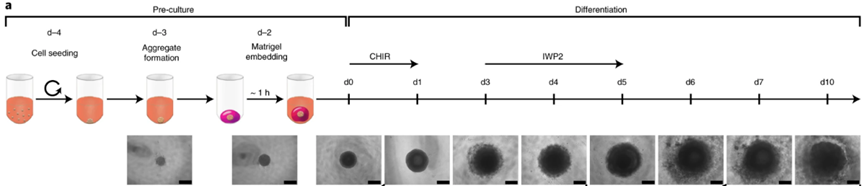
图1. hESCs来源的hCOs培养方案【1】
细胞来源
Human ESCs
培养基配方
|
|
MEFs 培养基 |
ESCs 培养基 |
中胚层培养基 |
心肌分化培养基(I) |
心肌分化培养基(II) |
心肌分化培养基(III) |
hCOs 形成培养基(I) |
hCOs 形成培养基(II) |
hCOs 形成培养基(III) |
hCOs 形成培养基(IV) |
近岸蛋白产品货号 |
|
基础培养基 |
DMEM-F12 |
RPMI-1640 |
RPMI-1640 |
RPMI-1640 |
RPMI-1640 |
RPMI-1640 |
DMEM-F12 |
RPMI-1640 |
RPMI-1640 |
RPMI-1640 |
|
|
penicillin-streptomycin |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
1% |
|
|
dFBS(v/v) |
10% |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
KnockOut 血清替代物(KSR) |
- |
20% |
20% |
- |
- |
- |
- |
- |
- |
- |
|
|
L-ascorbic |
- |
- |
200mM |
200mM |
200mM |
- |
230μM |
- |
- |
- |
|
|
GlutaMAX |
- |
1% |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
2-Mercaptoethanol |
- |
0.2% |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
sodium selenium |
- |
- |
- |
- |
- |
- |
14ng/ml |
- |
- |
- |
|
|
B-27(无insulin) |
- |
- |
1× |
1× |
- |
- |
- |
1× |
1× |
- |
|
|
B-27(含insulin) |
- |
- |
- |
- |
1× |
1× |
- |
- |
- |
1× |
|
|
insulin |
- |
- |
- |
- |
- |
- |
19.4ng/ml |
- |
- |
- |
|
|
FGF basic/FGF-2 |
- |
100ng/ml |
5ng/ml |
- |
- |
- |
100ng/ml |
- |
- |
- |
C046/C779 |
|
CHIR-99021 |
- |
- |
1μM |
- |
- |
- |
- |
7.5μM |
- |
- |
|
|
BMP-4 |
- |
- |
5ng/ml |
- |
- |
- |
- |
- |
- |
- |
|
|
Activin A |
- |
- |
9ng/ml |
- |
- |
- |
- |
- |
- |
- |
C687 |
|
IWP-2 |
- |
- |
- |
- |
- |
- |
- |
- |
5μM |
5μM |
|
|
IWP-4 |
- |
- |
- |
5μM |
5μM |
- |
- |
- |
- |
- |
|
|
NaHCO3 |
- |
- |
- |
- |
- |
- |
6.45mM |
- |
- |
- |
|
|
Transferrin |
- |
- |
- |
- |
- |
- |
10.7ng/ml |
- |
- |
- |
CJ41 |
|
TGFβ1 |
- |
- |
- |
- |
- |
- |
2ng/ml |
- |
- |
- |
CA59 |
|
Y27632 |
- |
- |
- |
- |
- |
- |
10μM |
- |
- |
- |
|
ESCs 培养和传代
1、将 100mm 培养皿包被 5ml 0.1%(w/v)的明胶,室温静置 15min 至明胶凝固。
2、在明胶上接种丝裂霉素处理过的 MEFs 细胞悬浮液,细胞数约为 1.8×106个。放置在 7℃,5%CO2 的培养箱中培养至细胞汇合度 70-80% 时进行传代。
3、吸去 MEFs 培养基,将 ESCs 接种于明胶上,添加 10ml ESCs 培养基,放置在 37℃,5%CO2 的培养箱中培养 3-5 天。
4、向 hESCs 中加入 1ml TrypLE Express,并将培养皿放置在 37℃ 条件下进行解离,直到所有的细胞都以小细胞块或单细胞的形式漂浮。
5、将所有细胞转移至离心管中,室温下 300g 离心 3min,收集沉淀细胞。加入 DMEM-F12 培养基,以 1:6 的比例接种在 Matrigel 包被的 24 孔培养板中,向每个孔中加入 0.5ml 预热的 mTeSR1 进行培养,在 2-4 天内细胞汇合度达到 85-90%。
心肌分化
6、用中胚层培养基进行换液,放置在 37℃,5%CO2 的培养箱中培养 3 天,每天换液一次。
7、用心肌分化培养基(I)进行换液,放置在 37℃,5%CO2 的培养箱中培养 3 天,每天换液一次。
8、用心肌分化培养基(II)进行换液,放置在 37℃,5%CO2 的培养箱中培养 7 天,每天换液一次。
9、用心肌分化培养基(III)进行换液,放置在 37℃,5%CO2 的培养箱中培养 2 天,每天换液一次。
10、分化后,吸出原培养基,加入含 2% I 型胶原蛋白酶和 20% FBS 的 PBS 溶液(含 Ca2+ 和 Mg2+),消化 60min 后,加入 0.25% Trypsin-EDTA 再消化 10min。
11、加入 MEM 完全培养基(10%FBS,1% penicillin-streptomycin,200mM L-ascorbic)终止消化,将所得细胞用 100μm 孔径滤膜过滤。
hCOs 培养
12、将细胞用 hCOs 形成培养基(I)重悬并进行细胞计数,按照 5,000 个/孔的密度接种于低吸附 96 孔板中。4℃ 条件下 300g 离心 3 min 后,放置在 37℃,5%CO2 的培养箱中过夜培养。
13、用 Matrigel 将每孔细胞进行包埋,放置于 37℃ 培养箱中使 Matrigel 固化。添加 hCOs 形成培养基(II)至完全没过 Matrigel,放置在 37℃,5%CO2 的培养箱中培养 1 天。
14、之后用 hCOs 形成培养基(I)进行换液,放置在 37℃,5%CO2 的培养箱中培养 1 天。
15、用 hCOs 形成培养基(III)进行换液,放置在 37℃,5%CO2 的培养箱中培养 2 天后,将培养基换成 hCOs 形成培养基(I),放置在 37℃,5%CO2 的培养箱中培养 1 天。
16、最后用 hCOs 形成培养基(IV)进行换液,放置在 37℃,5%CO2 的培养箱中培养 4-6 天。
hCOs 的应用和展望
hCOs 是一种类似于体内器官的三维细胞结构,在很大程度上,hCOs 比以前的模型更准确地保留了体内的生物学特征和功能。
随着生物技术的不断发展,hCOs 模型变得越来越复杂和成熟,极大地推进了心脏生理学领域的研究。
Tiburcy et al.【5】成功构建了具有心肌结构和功能特征的 hCOs,通过神经体液过度刺激来模拟人类心力衰竭情况。
并且在体外使用 hCOs 进行了药物测试,为今后针对心力衰竭开发新的治疗手段和药物提供了思路。
根据现有的报道,hCOs 具有产生自发和诱发动作电位的能力,并且具有比二维模型更高的传导速度,因此 hCOs 可用于研究致心律失常综合征中复杂的电生理现象。
Shinnawi et al.【6】使用 hiPSC 衍生的 HCOs 作为模型来评估抗心律失常候选药物的疗效。结果表明,应用奎尼丁和丙吡胺可延长动作电位持续时间,有效地缓解了心律失常。
目前 hCOs 仍然是相对简化的器官样组织,最重要的问题之一是缺乏丰富的血管网络等更复杂的结构。图 2 中的四种培养方法更好地模拟了多种细胞类型和亚区域之间的相互作用,这将有助于未来构建包含心室样和心房样结构和功能的 hCOs。
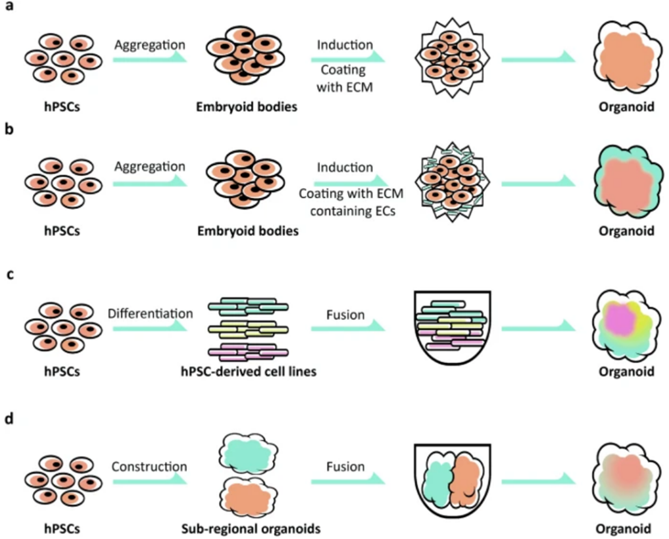
图2. 自组装 hCOs 形成示意图【7】
参考文献
【1】Drakhlis, L. et al. (2021). Human heart-forming organoids recapitulate early heart and foregut development. Nature Biotechnology, 39(6), 737-746.
【2】Hudson, J. et al. (2012). Primitive cardiac cells from human embryonic stem cells. Stem cells and development, 21(9), 1513-1523.
【3】Voges, H. K. et al. (2017). Development of a human cardiac organoid injury model reveals innate regenerative potential. Development, 144(6), 1118-1127.
【4】Costa, M. et al. (2008). Expansion of Human Embryonic Stem Cells In Vitro. Current Protocols in Stem Cell Biology, 5(1), 1C-1.
【5】Tiburcy, M. et al. (2017). Defined engineered human myocardium with advanced maturation for applications in heart failure modeling and repair. Circulation, 135(19), 1832-1847.
【6】Shinnawi, R. et al. (2019). Modeling reentry in the short QT syndrome with human-induced pluripotent stem cell–derived cardiac cell sheets. Journal of the American College of Cardiology, 73(18), 2310-2324.
【7】Zhao, D. et al. (2021). Cardiac organoid—A promising perspective of preclinical model. Stem Cell Research & Therapy, 12(1), 1-10.