合作专家 | 孙齐博士
生理学 首都医科大学
审核专家 | 张旭娟博士
生物医学工程 北京工业大学
原理
免疫荧光技术是在免疫学、生物化学和显微镜技术的基础上建立起来的一项技术。它是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光基团,再用这种荧光抗体(或抗原)作为探针检查组织内的相应抗原(或抗体)。利用荧光显微镜可以看见荧光所在的组织,从而确定抗原或抗体的性质和定位,以及定量(荧光面积或平均荧光强度等)。
用途
检测组织中某蛋白的表达,包括其表达与否、表达位置和相对含量。利用多色免疫荧光技术可同时检测多个蛋白,得到多个蛋白的共定位和表达荧光图像。
材料与仪器
步骤
若为冰冻切片,则进行以下步骤后直接进行第 5 步内源性过氧化物酶阻断:
一、样本处理
① 加固定剂(按下述固定剂选择固定条件:)
10% 中性缓冲福尔马林:在室温下固定 10 min;
冷冻丙酮:-20 ℃ 冷冻 10 min,风干;
甲醇:-20 ℃ 冷冻 10 min;
3% 甲醛:室温下固定 15 min;
3% 甲醛/甲醇:在 3% 甲醛溶液中室温固定 15 min,之后直接放入甲醇溶液中 -20 ℃ 固定 5 min。
② 1× PBS清洗 2 次,每次 5 min。
二、操作步骤
1、选取质量较好,厚度均匀的组织切片并做好标记,同时设立一张阴性对照切片;使用不同抗体的切片尽量选取连续切片,避免因组织差别大而影响结果分析的客观性;
2、石蜡溶解:将切片置于 70 ℃ 原位杂交仪中,烤片 30 min(无烤片条件也可忽略此步,适当增加脱蜡时间);
3、脱蜡:将烤过后的切片迅速放入二甲苯中,2 次,各 5 min。
4、梯度水化:100%、90%、80%、70% 的乙醇中各放置 5 min,蒸馏水中放置 5 min;
5、内源性过氧化物酶阻断:滴加 3% 过氧化氢,室温于湿盒内放置 10 min 后,蒸馏水中放置 1 min;
6、抗原修复:放置于 1 x CB 中,微波炉 80% 火力 4 min,40% 火力 8 min,冷却至室温;
7、(可选步骤)0.3% Triton室温通透 15 min;
8、封闭:吸干组织周围液体,滴加 10% NGS,放置于湿盒内,37 ℃ 30 min或室温 2 小时;
9、一抗:按抗体说明书建议比例使用 1% NGS 稀释抗体;吸干组织周围液体,滴加稀释好的一抗,其中阴性对照组仅滴加 1% NGS,放置于湿盒内,37 ℃ 孵育 2 小时,或 4 ℃过夜;
10、放置于 1 x PBS 中清洗 3 次,每次 5 min;
11、二抗:吸干组织周围液体,加入稀释好的荧光二抗,室温避光孵育1h 后,1xPBS 洗三次,每次 5 min;
12、染核:加入 Hoechst 荧光染料标记细胞核,室温孵育 15 min 后 1xPBS 洗两次,每次 5 min;
13、封片:滴加一滴抗荧光猝灭封片剂于组织上,盖玻片封片,置于显微镜下观察拍照。
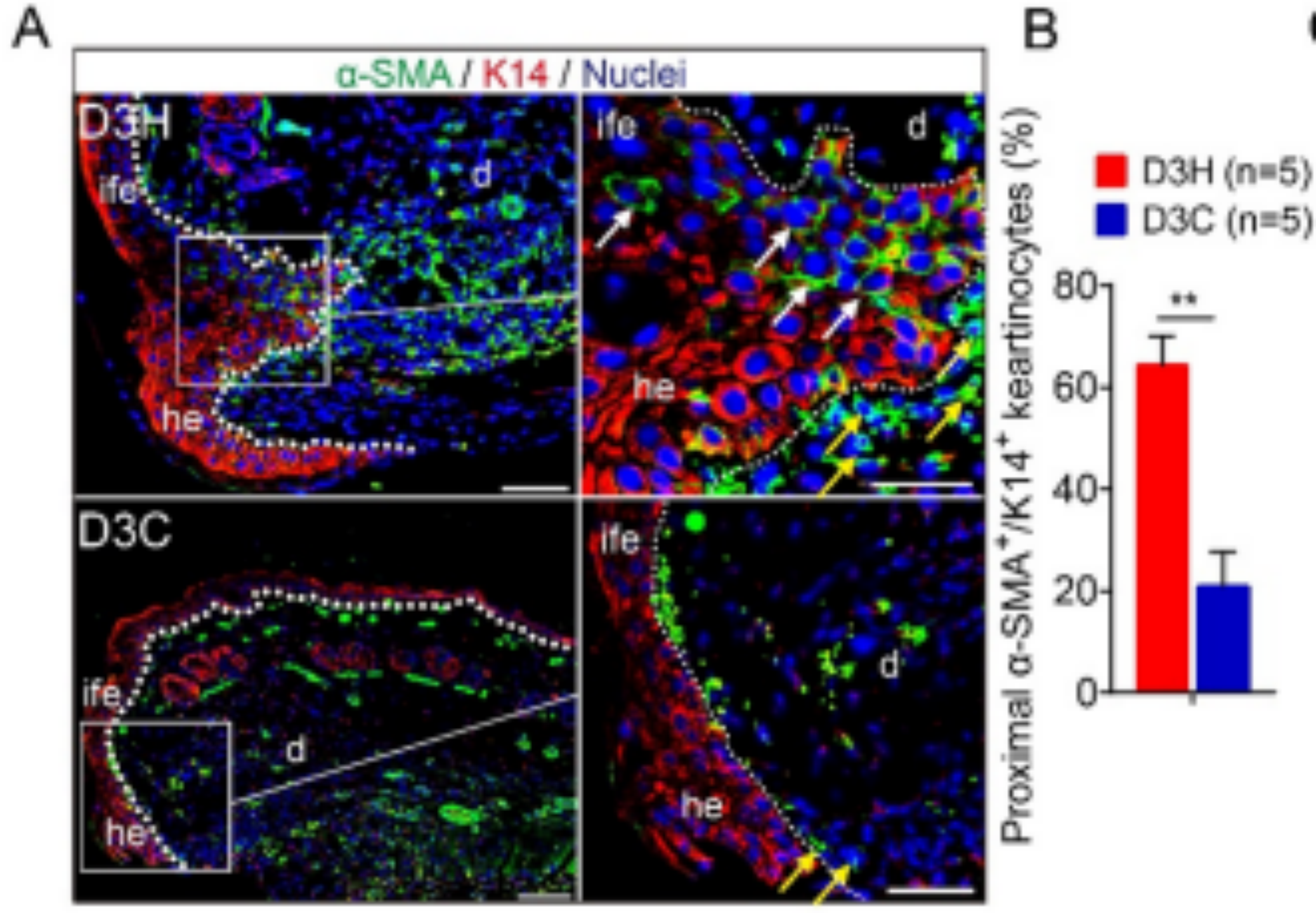
图1.皮肤组织多色IF结果示例图
https://doi.org/10.21203/rs.3.rs-1822552/v1中Fig.4A
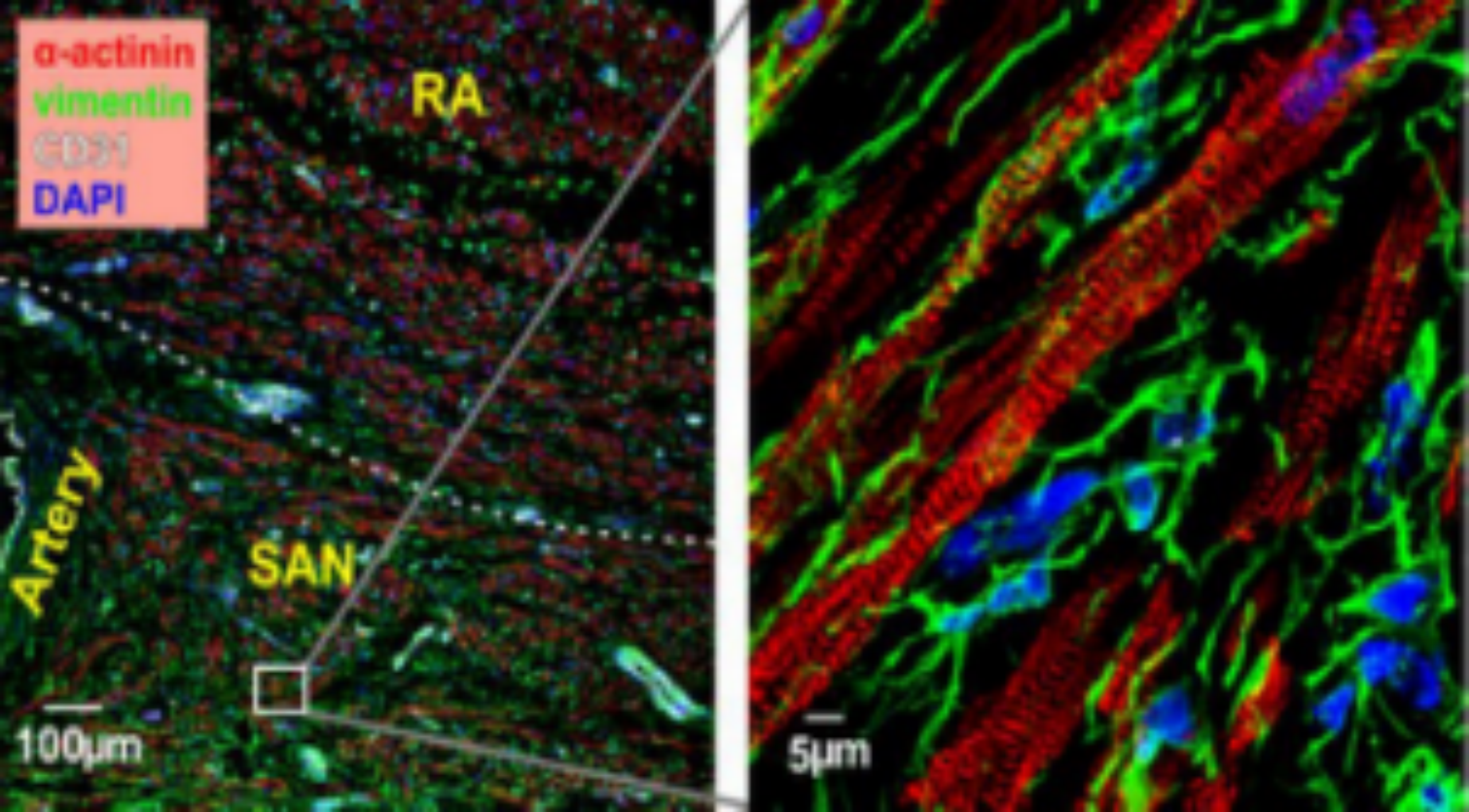
图2.心脏组织多色IF的结果示例图
DOI: 10.1161/CIRCULATIONAHA.120.051583
注意事项
1、若使用荧光标记的一抗,则孵育完成后,1 × PBS 清洗 3 次每次 5 min,直接进行染核和封片。
2、为了长期保存,请在 4 ℃ 下避光保存样品。
3、若无抗荧光猝灭封片剂,则滴加一滴 1 × PBS 后覆以盖玻片,置于显微镜下观察拍照,另外,注意避免长时间照射样品,防止荧光过快猝灭。
4、注意调整抗体的稀释比例,尽量按照实验室已摸索的稀释比例、抗体说明书以及文献中比例配制。
5、若想同时检测多种抗原,则需选择种属来源与样本组织不同的抗体,按抗体各自的说明书推荐终浓度混合后滴加至组织上进行孵育;二抗也按各自稀释比例混合后进行孵育,注意各荧光二抗波长需不同。
6、拍照时注意调节光强及曝光时间等参数。
常见问题
1、组织细胞无着色:可能实验操作问题,包括实验操作不当、实验材料异常、抗体选择和抗体质量问题等,或者本身蛋白不表达,这些均可通过设置阳性对照以及阴性对照实验来排除。
2、染色过浅:可能由于封闭时间过长,抗体浓度过低,抗体孵育温度不当或时间过短,操作过程中缓冲液残留过多或者间接稀释抗体浓度;应根据具体原因进行调整。
3、染色过深:可能由于封闭时间过短,抗体浓度过高,抗体孵育时间过长,洗涤不充分(洗涤次数少或时间短),或者滤光片选择不合适;应根据具体原因进行调整。
来源:丁香实验