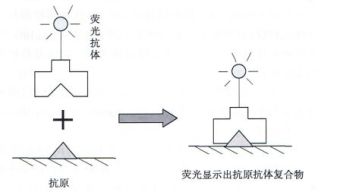
原理
直接法是以荧光素标记的抗体直接与标本内的抗原反应,形成抗原—荧光素标记抗体复合物。根据荧光的分布位置及强度,确定相应抗原的存在与否及其所在部位。
材料与仪器
步骤
1. 标本经固定后,PBS洗涤3×3 分钟;
2. 加荧光素标记的抗体,湿盒内37 ℃孵育50 分钟;
注意事项
直接法比较简单,特异性也较高,但每种荧光抗体只能检测一种相应的抗原,应用范围较窄,敏感性也较低。
对实验结果的观察、判断与分析是影响实验结果的重要环节,判断结果的好与坏、真与假需注意以下几点。
1.必须设立对照染色(阴性或阳性对照),没有对照染色的结果是没有说服力的。
2.正确判断真阴性和假阳性。
(I)了解抗原表达是否在特定部位,如VP阳性出现在神经元胞浆,Fos标记细胞胞核,若阳性产物不在抗原所在部位,通常认为是假阳性。
(2)对阴性结果,不能视为抗原不表达,应该参考他人的结果或进行相应的对照实验,寻找原因,判断是否为真阴性。
(3)在切片破损区域,出血坏死灶或刀痕等位置容易出现阳性表达,应鉴别分析。
(4)染色时间的掌控很关键,可以避免非特异着色或假阳性细胞。
3.所有免疫组化操作步骤均能影响其结果,判断的关键在于以下几点。
(l)组织切片完整,结构清晰,说明灌注取材、脱水、制片过程中没有问题。
(2)切片着色鲜艳,说明抗体种属之间配伍没有错误,染色步骤正常。
(3)阳性与阴性结果部位明确,说明所用抗体的特异性强。
4.切片例数、阳性产物数量统计、分析应符合统计学要求。
常见问题
染色步骤繁琐,因此每一步都很关键。在实验中常出现的问题及解决方法如下。
1进行免疫组织化学染色时,必须证明组织内显示阳性产物确实是抗原与相应抗体特异性结合所产生的。避免假阴性或假阳性造成的困扰,要严格对照实验才能对实验结果做出正确评价。
2掉片是染色过程中常遇到的问题之一。解决方法:
① 使用经多聚赖氨酸或APES包被过载片,黏附效果最好,但价格相对昂贵;
② 也可用经1%明胶包被的载玻片贴片;
③ 贴有切片的载片从-20℃拿出时,可先在4℃放置30min,后再放于室温充分晾干,避免切片因过快变热而掉片;
④对石蜡切片进行抗原修复时,应避免修复液干涸,切片暴露在外,需等修复液彻底降温后,再将切片拿出漂洗,禁忌骤热骤冷引起切片收缩掉片。
3.关于抗体涉及以下几个方面:
①种属在进行双重免疫标记时,要选择来源于两种不同种属动物的一抗,如选择来源于rabbit和mouse的抗体,二抗则用带有不同荧光素标记的,如抗rabbit或抗mouse二抗, FITC和Tex-Red;
②孵育时间和温度两种一抗可以同时孵育,然后加入相对应的抗-抗的二抗进行孵育,一抗孵育时间室温至少需要16h,二抗孵育室温不宜超过4h,选择4℃孵育比较好,背景比较清晰,另外孵育时夏天特别注意室温温度;
③抗体稀释液通常第一抗体选择1%牛血清白蛋白进行稀释,第二抗体选择用0.01mol/LPBS稀释。
4.免疫组织化学染色中的非特异性的问题,是决定结果好坏的关键问题,其核心问题是交叉反应。选择特异性强、亲和力高、稀释度高的第一抗体是避免非特异染色最有效的方法。实验中常用到的抗体主要是单克隆抗体和多克隆抗体。单抗是针对单-抗原决定簇制备的抗体,具有特异性强、重复性好等优点,但在提纯过程中易变性,稳定性差;多抗是将纯化的抗原直接免疫动物后,从动物血中获得的免疫血清,其可以识别多个抗原表位,因此特异性相对较低、易产生抗体的交叉反应、重复性差、每批次都有可能不同。在实际工作中,可根据具体需要以及参考文献的报道选择合适的抗体。其他原因及解决办法如下。
(1)抗原间的交叉反应主要是标本固定不当或组织抗原封闭不全。每个抗原有不同的抗原决定簇,也可能有类似的抗原决定簇。因此可以选择结构相近的抗原做抗体吸收实验以避免抗原间的交叉反应。
(2)抗体与抗原除待检测的抗原外,组织中还可能存在类属抗原,也可与相应抗体结合。通常用2%-5%牛血清白蛋白或二抗来源的动物血清进行封闭。
(3)二抗第二抗体产生的非特异性主要是非IgG蛋白或非特异的IgG蛋白之间,通过特异性反应或通过非特异的疏水键与组织或细胞结合,产生非特异性染色。处理方法同上。
(4)荧光性非特异组织有自发荧光;部分游离荧光素残留在二抗中,未与抗体蛋白质结合;抗体分子上标记的荧光素分子太多,这种过量标记的抗体分子带了过多的阴离子,可吸附于正常组织上而呈现非特异性染色。解决办法可以通过对照实验或PBS代替进行鉴别和排除。注意选择特异性强、质量好、纯度高的荧光二抗。
(5)内源性过氧化物酶若标本因灌流固定不当,可能存在红细胞和粒细胞中的内源性过氧化物酶。可以通过甲醇-H202处理切片,避免DAB反应形成非特异染色。
5.片子着色不均匀现象,主要是:
①石蜡切片染色,脱蜡不充分,可以先在60℃烤箱烤1h;
②脱水不彻底,需配置新鲜的梯度酒精;
③贴片孵育抗体时抗体覆盖不均匀,切片倾斜,抗体流失等原因,需平放切片,切片擦干后再加抗体,也可以用免疫组化笔(在载玻片上的有组织的边缘画圆,防止抗体外溢),既节约抗体又避免抗体流失;
④冰冻切片漂染,每组切片不宜太多,否则互相重叠,导致接触抗体不均匀。
6.切片染色背景太深,不易区分特异性与非特异性着色。这主要是:
①抗体孵育时间过长或抗体浓度过高;
②抗体质量差或变质;
③DAB浓度过高,显色时间过长,或反应时温度过高;
④ PBS冲洗不充分,残留抗体增强着色;
⑤ 切片染色过程中出现干片,而导致非特异性着色增强;
⑥切片在缓冲液或修复液中浸泡时间太久(大于24h),不可室温长时间放置。
7.石蜡切片抗原修复方法很多,从弱到强有胰酶修复、微波修复、高压修复。修复液也分若干种,如pH6.0袧橡酸钠修复液、pH8.0的乙二氨四乙酸二钠(EDTA)修复液、pH9.0的EDTA-Tris修复液等,修复时间也根据标本、抗原、抗体等选择。
8.各个步骤之间的漂洗非常重要,可以防止一抗、二抗残留试剂引起的非特异着色。如果染色抗体种类较多,切片组别较多时不仅漂洗时间要足够,而且还可以单独漂洗,防止抗体之间的交叉污染。
参考:《组织培养和分子细胞学技术》北京出版社
来源:丁香实验