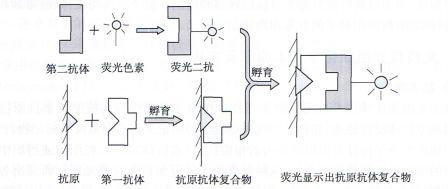
原理
材料与仪器
步骤
2. 滴加一抗,37 ℃40 分钟或4 ℃过夜;
3. PBS洗3x3 分钟;
4. 滴加荧光标记二抗37 ℃,40 分钟;
5. PBS洗3x3 分钟;
6. 0.1 %伊文氏兰复染;
7. PBS洗3x3 分钟;
8. 缓冲甘油封片,镜检。
注意事项
1.种属在进行双重免疫标记时,要选择来源于两种不同种属动物的一抗,如选择来源于rabbit和mouse的抗体,二抗则用带有不同荧光素标记的,如抗rabbit或抗mouse二抗, FITC和Tex-Red;
2.孵育时间和温度相同的两种一抗可以同时孵育,然后加入相对应的一抗的二抗进行孵育,一抗孵育时间室温至少需要16h,二抗孵育室温不宜超过4h,选择4℃孵育比较好,背景比较清晰,另外孵育时夏天特别注意室温温度;
3.抗体稀释液通常第一抗体选择1%牛血清白蛋白进行稀释,第二抗体选择用0.01mol/L的PBS稀释。
常见问题
1.免疫组织化学染色中的非特异性的问题,是决定结果好坏的关键问题,其核心问题是交叉反应。选择特异性强、亲和力高、稀释度高的第一抗体是避免非特异染色最有效的方法。实验中常用到的抗体主要是单克隆抗体和多克隆抗体。单抗是针对单一抗原决定簇制备的抗体,具有特异性强、重复性好等优点,但在提纯过程中易变性,稳定性差;多抗是将纯化的抗原直接免疫动物后,从动物血中获得的免疫血清,其可以识别多个抗原表位,因此特异性相对较低、易产生抗体的交叉反应、重复性差、每批次都有可能不同。在实际工作中,可根据具体需要以及参考文献的报道选择合适的抗体。其他原因及解决办法如下。
(1)抗原间的交叉反应主要是标本固定不当或组织抗原封闭不全。每个抗原有不同的抗原决定簇,也可能有类似的抗原决定簇。因此可以选择结构相近的抗原做抗体吸收实验以避免抗原间的交叉反应。
(2)抗体与抗原除待检测的抗原外,组织中还可能存在类属抗原,也可与相应抗体结合。通常用2%-5%牛血清白蛋白或二抗来源的动物血清进行封闭。
(3)第二抗体产生的非特异性主要是非IgG蛋白或非特异的IgG蛋白之间,通过特异性反应或通过非特异的疏水键与组织或细胞结合,产生非特异性染色。处理方法同上。
(4)荧光性非特异组织有自发荧光;部分游离荧光素残留在二抗中,未与抗体蛋白质结合;抗体分子上标记的荧光素分子太多,这种过量标记的抗体分子带了过多的阴离子,可吸附于正常组织上而呈现非特异性染色。解决办法可以通过对照实验或PBS代替进行鉴别和排除。注意选择特异性强、质量好、纯度高的荧光二抗。
(5)内源性过氧化物酶若标本因灌流固定不当,可能存在红细胞和粒细胞中的内源性过氧化物酶。可以通过甲醇-H202处理切片,避免DAB反应形成非特异染色。
2.片子着色不均匀现象,主要是:
(1)石蜡切片染色,脱蜡不充分,可以先在60℃烤箱烤1h;
(2)脱水不彻底,需配置新鲜的梯度酒精;
(3)贴片孵育抗体时抗体覆盖不均匀,切片倾斜,抗体流失等原因,需平放切片,切片擦干后再加抗体,也可以用免疫组化笔(在载玻片上的有组织的边缘画圆,防止抗体外溢),既节约抗体又避免抗体流失;
(4)冰冻切片漂染,每组切片不宜太多,否则互相重叠,导致接触抗体不均匀。
3.切片染色背景太深,不易区分特异性与非特异性着色。这主要是:
(1)抗体孵育时间过长或抗体浓度过高;
(2)抗体质量差或变质;
(3)DAB浓度过高,显色时间过长,或反应时温度过高;
(4)PBS冲洗不充分,残留抗体增强着色;
(5)切片染色过程中出现干片,而导致非特异性着色增强;
(6)切片在缓冲液或修复液中浸泡时间太久(大于24h),不可室温长时间放置。
4.石蜡切片抗原修复方法很多,从弱到强有胰酶修复、微波修复、高压修复。修复液也分若干种,如pH6.0袧橡酸钠修复液、pH8.0的乙二氨四乙酸二钠(EDTA)修复液、pH9.0的EDTA-Tris修复液等,修复时间也根据标本、抗原、抗体等选择。
5.各个步骤之间的漂洗非常重要,可以防止一抗、二抗残留试剂引起的非特异着色。如果染色抗体种类较多,切片组别较多时不仅漂洗时间要足够,而且还可以单独漂洗,防止抗体之间的交叉污染。
来源《组织培养和分子细胞学技术》(北京出版社)
来源:丁香实验