简介
FACSVantage SE 流式细胞仪按如下设置:
FL1 和 FL2 电子测量通道连接第 3 激光器(紫色氪离子激光器)检测 CCF2-AM 蓝色和绿色荧光信号;
FL6 电子测量通道连接第 1 激光器(488 nm 氩离子激光器)检测 PE-Cy7;
FL4 和 FL5 用标准的第 2 激光器(647 nm 的氮离子激光器)的位置来检测 APC 和 APC-Cy7;
所有的荧光检测使用对数放大。第 1 激光器的前向散射是用于机器的激发。来自第 1 激光器的前向散射和侧向散射用于描述被关注的细胞。
材料与仪器
步骤
流式细胞术分析的基本过程可分为如下几步:
(一)流式细胞仪的数据采集
A 调节前向和侧向散射光,将被关注的细胞放在图像中合适的标尺位置上。
B 调节绿色和蓝色(第 3 激光器)PMT 检测器电压使得细胞位于标尺大致的中间位置。这一调节采用加载了 CCF2-AM 的未感染细胞进行。在对角线上的细胞群反映了蓝色和绿色荧光的恒定比例。在免疫标记完成之后,把在 PE-Cy7,APC 和 APC-Cy7 检测通道上的细胞自发荧光设置在第 1 个十进制对数刻度范围之内。接着将 CCF2-AM 加载的样品以及抗 CD3-APC、抗 CD8-APC-Cy7 或抗 CD4-PE-Cy7 单染的细胞上机分析,用于 FL4 和 FL5 之间补偿的设置,为 PE-Cy7 和 APC-Cy7 之间的软件补偿调节提供对照。
C 最后,分析被感染的样品。细胞感染 HIV 后,蓝色与绿色的比例增加,并且部分细胞群向蓝色与绿色荧光高比例方向移动。
(二)用 FlowJo 软件分析数据
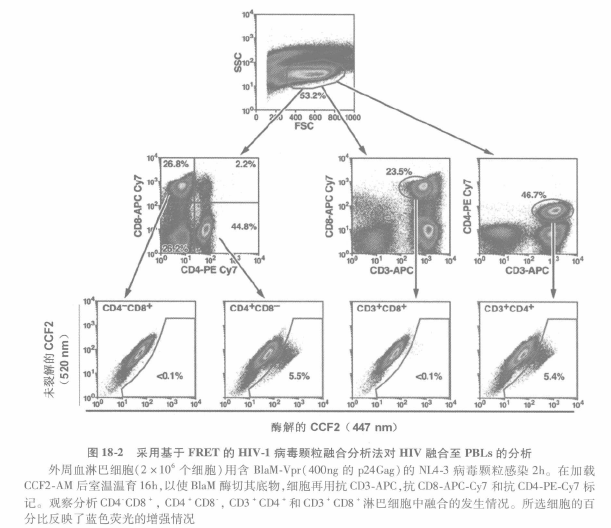
A 数据可用 FLowJo 软件分析。如有需要,软件可对 APC-Cy7 和 PE-Cy7 之间进行事后补偿调节。图 18-2 显示了从含有 BlaM-Vpr 的 NL4-3 感染 PBLs 获取的典型数据,及为分析该数据提供的设门策略建议。
来源:丁香实验