简介
亲和层析(affinity chromatography)是蛋白质分离纯化最有效的方法之一,在个别情况下,仅此一步纯化即可得到高纯度的目的蛋白。
原理
亲和层析的基本原理是基于生物分子与层析柱上的配体发生特异性可逆结合的原理。亲和层析的最大特点是特异性强、简便和高效,对含量少又不稳定的活性生物分子更为有效。但是,亲和层析有一定的局限性,且成本较高。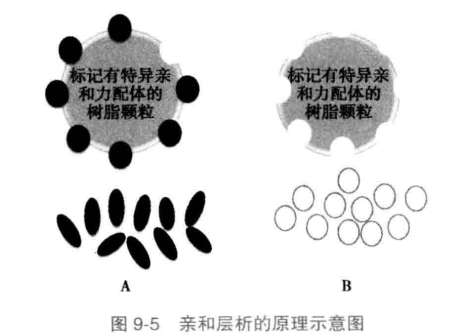
用途
亲和层析的最大特点是特异性强、简便和高效,对含量少又不稳定的活性生物分子更为有效。
材料与仪器
试剂:
0.15 mol/L NaCl 的磷酸缓冲液或 0.1~0.2 mol/L Tris 缓冲液(样品缓冲液)、
抑菌剂:0.5% 乙酸氯已定(乙酸洗必泰)或 0.05% 苯甲醇
仪器:
亲和层析柱
步骤
亲和层析的基本过程可分为如下几步:
1.亲和层析柱的制备首先根据固定相配体的吸附能力和目的蛋白的含量计算装柱体积,一般用量应是计算用量的 2~3 倍。例如,用于谷胱甘肽巯基转移酶(GST)亲和层析纯化的还原型谷胱甘肽偶联的琼脂糖凝胶颗粒 1 ml 可以结合 10 mg GST 蛋白,若要纯化 5 mg 目的蛋白,则用 1 ml 还原型谷胱甘肽偶联的琼脂糖凝胶颗粒装柱。亲和层析柱的装柱方法与离子交换层析法基本相同。
2.样品上样样品一般是溶在含有 0.15 mol/L NaCl 的磷酸缓冲液或 0.1~0.2 mol/L Tris 缓冲液(样品缓冲液)中,以减少配体与蛋白质之间的非特异性结合。为了增加蛋白质与配体的结合,上样时应用低流速,也可以循环重复,还可将亲和层析凝胶颗粒与样品直接混合,在 4 ℃ 下搅拌过夜,然后再装柱。
3.目的蛋白的洗脱和收集洗脱之前,要用至少 10 倍柱床体积的样品缓冲液去除未结合的杂质,一般以流出液的 A280 值达到基线为佳,流速为 1 ml/min。目的蛋白的洗脱可以分为特异性洗脱和非特异性洗脱。前者是洗脱液中含有与目的蛋白竞争结合在树脂颗粒配体的底物,例如,结合于谷胱甘肽偶联的琼脂糖凝胶颗粒的 GST 蛋白可以用谷胱甘肽竞争使 GST 蛋白被洗脱。后者是通过改变盐浓度、pH、温度或使用非离子去垢剂等,使目的蛋白与配体的结合能力下降,洗脱出目的蛋白。这种洗脱方式的具体操作与离子交换层析法类似。在亲和层析中,尤其是利用抗原做配体时,往往需要利用酸性缓冲液(最常用的是 pH2.5 的甘氨酸-盐酸缓冲液)洗脱目的抗体。在这种情况下,需要以最快的速度用碱性溶液(如 1.0 mol/L 的 Tris)将洗脱液的 pH 值调回到中性,以防止目的蛋白变性失活。一般应该在实验前做好对洗脱液进行中和的预实验,明确在一定体积的洗脱液中加入多少体积的中和用溶液,以便在收集洗脱液后迅速加入。
4.亲和层析柱的再生和保存亲和层析树脂颗粒价格较昂贵,使用后应该仔细清洗、再生后按照说明保存。柱的清洗可以用高浓度的特异性洗脱液,也可以用高浓度的非特异性洗脱液,如 0.5~1.0 mol/L NaCl。但是盐浓度不宜过高,否则会改变蛋白质的构象、破坏配体或改变它的活度及改变配体对样品的结合能力等。清洗过的亲和层析柱储存在 8 ℃ 以下,应防止凝胶冻结。可加抑菌剂,如 0.5% 乙酸氯已定(乙酸洗必泰)或 0.05% 苯甲醇。
来源:丁香实验