简介
研究背景:
G蛋白偶联受体 (GPCR) 构成人类基因组中最大的一类膜蛋白,具有 >800 个独特的受体。它们被极其多样化的刺激激活,这些刺激的物理化学性质和大小各不相同;从光子到小的生物胺,再到肽和糖蛋白 。GPCRs共享一个蛋白质结构,包括七个跨膜螺旋,并且在从病毒和黏菌到植物和人类的生物体基因组中都有代表。这类受体是细胞信号传导的核心,因此,这项研究对于药物治疗靶点发现很关键。。
尽管普遍承认将GPCRs暴露于洗涤剂会扰乱和破坏受体的稳定性,但绝对需要洗涤剂来溶解GPCRs。尽管通过使用非常规表面活性剂或纳米圆盘在减少清洁剂的有害影响方面取得了重大进展,但理想的情况是在水溶液中以类似天然的状态生成GPCR,完成环状脂质,但不暴露于洗涤剂。在本研究中,我们报告了GPCR的第一次溶解和纯化,即人腺苷A2A受体 (A2AR),通过利用GPCR直接从膜到纳米级苯乙烯马来酸的自发封装,在任何阶段不使用去污剂 (SMA) 脂质颗粒 (SMALP)。这会生成由SMA聚合物环切除和稳定的原生膜的纳米部分 。
此外,我们通过将SMALP溶解应用于对GPCR研究至关重要的两个应用来证明我们方法的实用性:
(i) 从常用的过表达系统 (酵母) 中纯化毫克量的功能性GPCR和
(ii) 溶解GPCR来自培养中的转染哺乳动物细胞,保留环状天然膜环境,用于下游应用,例如药物发现测定。
原理
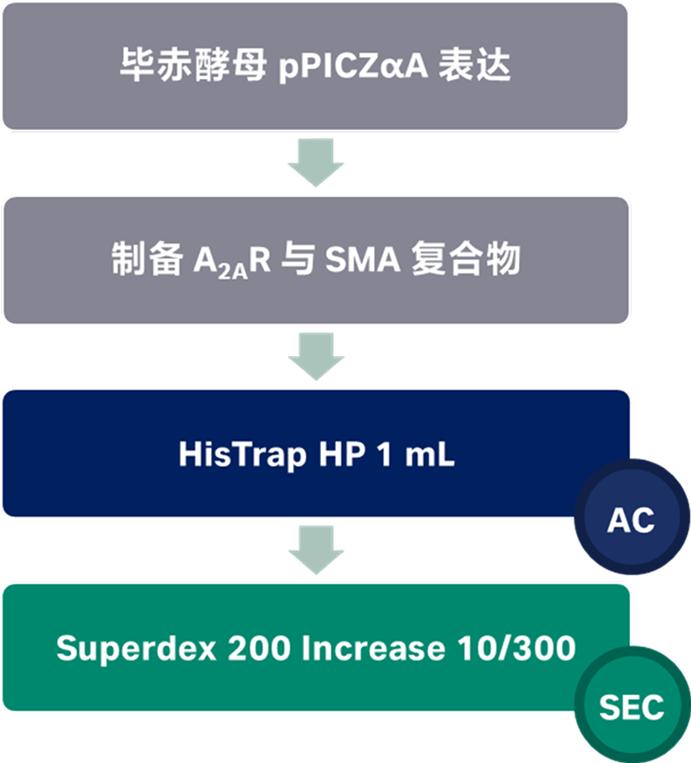
图3 GPCR的溶解和纯化流程图
材料与仪器
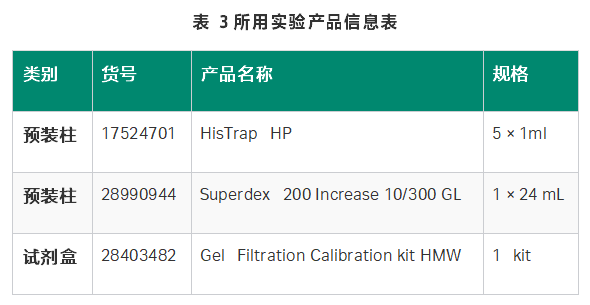
步骤
实验方法:
制备A2AR与SMA的复合物:
表达酵母膜的A2AR最终浓度为40 mg/mL (湿重) 与SMA (2.5% w/v 最终浓度)在 25℃温和搅拌下孵育 20 小时。未溶解的材料在 4℃下以100 000 g 沉降 1 小时,得到含有A2AR-SMALP的上清液。用A2AR瞬时转染的HEK293T细胞在转染后48小时用冰冷的PBS洗涤,然后刮入含有2% (w/v) SMA的1 mL/皿的收获缓冲液 (20 mM HEPES、1 mM EGTA、1 mM 醋酸镁、pH 7.4) 中和5 个单位/毫升的苯并酶。样品在 37℃下孵育 1 小时,然后在 4℃下以100 000 g 离心1小时。
Ni2+-NTA亲和纯化:
SMA溶解的制剂通过HisTrap HP 1 mL Ni2+-NTA琼脂糖凝胶 (GE Healthcare) 在4℃下再循环过夜。用20柱体积 (cv) 的50 mM Tris/HCl、pH 8.0、500 mM NaCl、10%甘油、20-60 mM咪唑、完全不含EDTA的蛋白酶抑制剂洗涤柱。使用以0.5 mL分管收集的 250 mM咪唑 (10 cv) 实现A2AR-SMALP的洗脱。将含有A2AR-SMALP的洗脱组分合并,用缓冲液 (50 mM Tris/HCl、150 mM NaCl、10%甘油、完全蛋白酶抑制剂,然后使用离心浓缩器 (Vivaspin 20, 30 kDa ,Sigma)) 透析过夜。蛋白质印迹分析使用抗组氨酸一抗Takara Bio Europe 和抗小鼠HRP (辣根过氧化物酶;NEB) 二抗 (均以1:5000稀释) 使用化学发光检测试剂盒 (Geneflow) 进行可视化。
凝胶过滤分析:
凝胶过滤实验在20℃下使用Superdex 200 10/300 GL色谱柱在ÄKTA Purifier system (GE Healthcare) 上用缓冲液 (50 mM Tris,300 mM NaCl,pH 8.0) 预平衡,流速为 1 mL/min。所有实验均使用50 mM Tris、pH 8和300 mM NaCl 进行,流速为1 mL/min。使用标准卵清蛋白 (43 kDa)、canalbumin (75 kDa)、醛缩酶 (158 kDa)、铁蛋白 (440 kDa) 和甲状腺球蛋白 (669 kDa) (GE Healthcare) 为蛋白Marker。
Reference:
Wheatley et al. Biosci. Rep. (2015) / 35 / art:e00188
来源:丁香实验