简介
PCR 法检测支原体污染是 20 世纪 80 年代中期建立起来的一种体外 DNA 扩增实验,其该实验具有灵敏度高、特异性强、快速的特点,但其对实验环境的要求严格,实验成本较高,有时还有假阳性的现象出现。
原理
PCR 法检测支原体污染的基本原理是酶促 DNA 合成反应,即在 DNA 模板、引物和脱氧核糖核酸存在下,经 DNA 聚合酶的作用,使 DNA 链扩增延伸。
材料与仪器
步骤
PCR 法检测支原体污染的基本过程可分为以下几步:
(1)样品的收集
待测细胞用无双抗培养基培养 7 d,用无菌容器取上清液 500 μl,4 ℃ 保存待测。
(2)模板的制作
在无菌的条件下,取细胞培养上清液 100 μl 于一无菌的 0.5 ml 塑料离心管内,盖好盖子,95 ℃ 水浴加热 5 min。
(3)打开盖子,向管内加 StrataClean 树脂 10 μl,盖好盖子,旋涡混悬器混合,离心 5~10 s,吸取上清至一新的塑料离心管中,模板制作完毕,4 ℃ 保存。
(4)PCR 反应反应体系最适条件为:10 mmol/L Tris-HCl(pH8.38),50 mmol/L KC1,1.5~2.5 mmol/L MgCl2,200μmol/L dNTP,2U Taq DNA 聚合酶;总反应体系为 50 μl,反应用去离子水均需用 12000 μJ/c㎡紫外灯照射。
A. 在 0.5 ml 塑料离心管中加入 35.2 μl 去离子水及 5 μl 10 x Taq 反应缓冲液。
B. 依次加入下列成分:0.4 μl dNTP(25 mmol/L);0.4 μl Taq 酶(5 U/μl);2 μl 引物。
C. 加 2 μl 去离子水,总体积 45 μl。
D. 加 5 μl 已制成的模板到反应体系中。
E. 阳性对照、内对照各 5 μl 加入到各自的反应体系中。
F. 取 1 支含有以上反应体系的离心管,加入 5 μl 去离子水作为阴性对照管。
G. 在反应体系中加入 100 μl 矿物油。
H. PCR 程序:
| 程序 | 循环数/次 | 温度/℃ | 时间/min | 程序 | 循环数/次 | 温度/℃ | 时间/min |
| 1 | 1 | 94 | 2 | 2 | 40 | 94 | 1 |
| 50 | 2 | 50 | 1 | ||||
| 72 | 2 | 72 | 2 |
(5)琼脂糖凝胶电泳
PCR 反应结束后,进行琼脂糖凝胶电泳,琼脂糖凝胶浓度 2%。电泳结束后,凝胶成像分析结果。
注意事项
1. PCR 反应的前期操作应在无菌环境中进行。
2. 检测前,待测细胞要用无双抗培养基培养 7 d。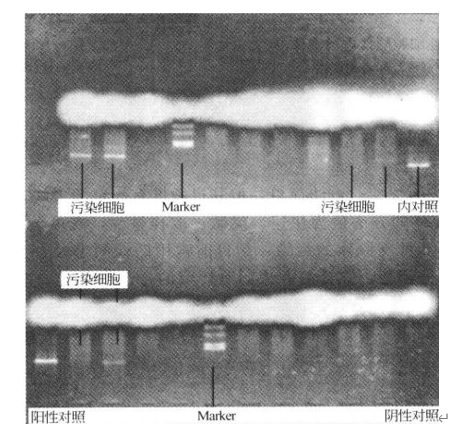

来源:丁香实验