4 个回答
balalaLy
酶消化成单个细胞培养,或者组织块培养。关键是不同的组织不同的细胞需要的酶和消化时间需要根据实际情况优化,还有最终的细胞纯化。
loveliufudan
从肿瘤组织中分离出单个的细胞可以采用组织消化的方法,以下是常规的步骤:
所需试剂材料:
DMEM/F12培养基或者其它适合该细胞类型的培养基
酶解液:含有胰酶和DNA酶的PBS缓冲液(如TrypLE)
过筛器或切碎器
15ml和50ml离心管
显微镜
操作步骤:
1.将肿瘤组织放入含有预先冷却好的DMEM/F12培养基的离心管中,并将其放入冰箱中,让其冷却。
2.用过筛器或切碎器将组织分成较小的块,以利于酶解。
3.将分割好的组织块放入含有酶解液的15ml离心管中,混匀,并放入37℃水浴中酶解1-2小时。注意酶解液浓度和时间的控制,以免影响细胞生存和功能。
4.酶解结束后,离心1-2分钟,将胶体沉淀去除,并加入预先冷却好的DMEM/F12培养基,重悬细胞沉淀。
5.将细胞悬液过滤,以去除组织残渣,然后用DMEM/F12培养基洗涤细胞,离心去除培养基,最后重悬细胞沉淀。
6.在无菌条件下将细胞种植到含有DMEM/F12培养基和10%胎牛血清的培养皿中,放入培养箱中,设置37℃和5% CO2的环境条件。
7.每两天更换一次培养基,观察细胞的生长状态,直至细胞密度达到足够的数量。
需要注意的是,每种肿瘤组织细胞的培养条件可能不同,因此,最好选择适合特定细胞类型的培养基、酶解液和血清。在实验操作过程中也需要保持无菌条件,以免细胞污染影响实验结果。
土井挞克树
1: 酶消化,
先把肿瘤组织取下后,分离肿瘤组织,并切成1立方毫米左右的小块,然后加入collagenase I + 30mg/ml DNase 在37度浮箱里消化1个小时。
然后加入有血清的培养基中止消化,用200目的滤网过滤, 离心(1000r/5min),弃上清,用PBS洗一次后,在离心,然后加入 1640培养基+10%血清+2% PBS,放入培养箱培养。
2: 直接组织块培养
把肿瘤组织取下后,分离肿瘤细胞,切成1立方毫米左右的小块,分散的放入 有1640培养基+10%血清+2% PBS的培养瓶中,放入培养箱中培养。
sswei
1、取材:
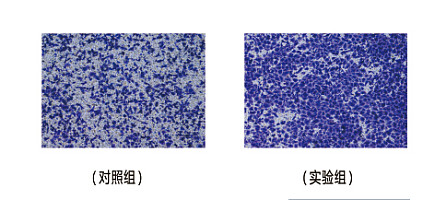
人肿瘤细胞来自外科手术或活检瘤组织。取材部位非常重要,体积较大的肿瘤组织中有退变或坏死区,取材时尽量避免用退变组织,要挑选活力较好的部位。癌性转移淋巴结或胸腹水是好的培养材料。取材后宜尽快进行培养,如因故不能立即培养,可贮存于4℃中,但不宜栽过24小时。
2、培养基:
肿瘤细胞对培养基的要求不如正常细胞严格,一般常用的 RPMIl640、 DMEM、Mc-Coy5A等培养基等皆可用于肿瘤细胞培养。肿瘤细胞对血清的需求比正常细胞低,正常细胞培养不加血清不能生长,肿瘤细胞在低血清培养基中也能生长。肿瘤细胞对培养环境适应性较大,是因肿瘤细胞有自泌(Autocrine)性产生促生长物质之故。但这并不说明肿瘤细胞完全不需要这些成分。按不同细胞需要不同的生长因子;肿瘤细胞与正常细胞之间、肿瘤细胞与肿瘤细胞之间对生长因子的需求都存在着差异。但大多数肿瘤细胞培养中仍需要生长因子。有的还需特异性生长因子〔如乳腺癌细胞等)。总之培养肿瘤细胞仍需加血清和相关生长因子培养更易成功。
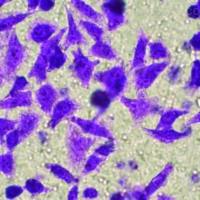
3、成纤维细胞的排除:
成纤维细胞常与肿瘤细胞同时混杂生长,致难以纯化肿瘤细胞。而且成纤维细胞常比肿瘤细胞生长得快,最终能压制肿瘤细胞的生长。因此排除成纤维细胞成为肿瘤细胞培养中的关键。排除成纤维细胞有多种方法。
1、机械刮除法:是用不锈钢丝末端插有橡胶刮头(用胶塞剪成三角形插以不锈钢丝)、或裹少许脱脂棉制成,装入试管中高压灭菌后备用(也可用特制电热烧灼器刮除)。刮除程序为:
(1)标记:镜下观察,用不脱色笔在培养瓶皿的背面圈下生长肿瘤细胞的部位;
(2)刮除:弃掉培养液,把无菌胶刮伸入瓶皿中,肉眼或显微镜窥视下,刮除无标记空间;
(3)用Hanks液冲洗一两次,洗除被刮掉的细胞;
(4)注入培养液继续培养,如发现仍有成纤维细胞残留,可重复刮除至完全除掉为止。