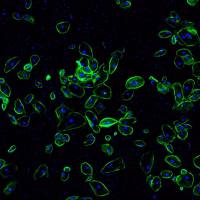
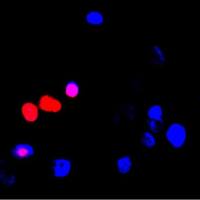
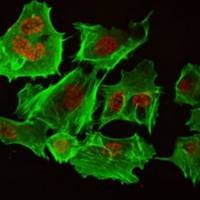
AM/PI活死细胞染色红绿荧光重叠问题
yfryfryfr
使用的是索莱宝的AM/PI活死细胞染色试剂盒
步骤是这样的:
- 细胞种24孔板培养7-8小时加入药物处理,24小时后进行实验,先用4%多聚甲醛对细胞固定15分钟,使用试剂盒自带的缓冲液清洗3次,每次5分钟,
- 将1.3微升AM和2.6微升的PI溶解在1毫升缓冲液中,并加在每个孔内,孵箱孵育20分钟后用PBS清洗两次,倒置荧光显微镜下观察,
图像发现红绿荧光重叠在同一个细胞内,想问问大家有没有过这种情况,该如何处理
6 个回答
哼哼哈哈Yolk
请问你解决了吗,我也遇到了同样的问题,红绿荧光重叠在同一个细胞内
dxy_gcvb0ilr
甲醛固定不是就把细胞杀死了吗?肯定染出来是红色吧?
Eason老歌迷
既然发生了重叠,说明细胞都死了,可能是前期处理时细胞已经老化死亡了。
精准检验每一天
估计都是死的,但是不确定是哪个环节出了问题,有可能是传代或者是溶解的时候,还是要好好查一下自己的实验步骤!
bamboopiggy
你看没看试剂盒的说明书?你PI染的时间太长了。或者是。由于 Calcein 和 PI-DNA 都可被 490 nm 激发,因此可用荧光显微镜同时观察活细胞和死细胞。这个原因。
贴壁细胞经 0.25%胰酶-EDTA 消化后,收集细胞,用 1x 的Assay Buffer 洗涤细胞,450g,离心 5min,2 次,去除胰酶及残留的酯酶。
染色步骤 (1) 离心得到的细胞沉淀用 1×Assay Buffer 重悬,使重悬后细胞悬液计数细胞量为1×105~6个/ml。(2) 每 1ml 的细胞量加入 1-2ul 的 Calcein-AM(原液),吹打混匀,37℃避光孵育20min-25min。(3) 将试剂盒自带的 PI 原液取 3-5ul 加入上述染色细胞中,室温避光染色5min。(4) 孵育荧光后的细胞,450g,5min,离心去除染色液。 注:细胞进行荧光染色时建议全程避光。 (5) 用 1x 的 PBS 清洗细胞 450g,5min,离心后用 1x PBS 重悬细胞,取3-5ul 滴在洁净的载玻片上,用干净的盖玻片压片后,请及时荧光镜检。 (6) 荧光显微镜下使用 490±10 nm 激发滤片同时检测活细胞(黄绿色荧光)以及死细胞(红色荧光)。另外,使用 545nm 的发射滤片仅能观察到死细胞。也可以直接在荧光酶标仪下使用合适的滤片进行检测。
此用户已注销
是因为都死了吧,绿色的能染活的和死的,红的染死的,这么看来基本都是死的
yfryfryfr![]()
难道是因为我前面用多聚甲醛固定的原因?我药物的话浓度已经很低了
相关问答