流式细胞术样本制备技术
Elabscience
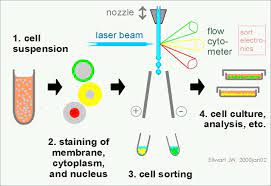
单细胞是流式细胞术对细胞进行分析检测的前提条件。在应用流式细胞术中,制备出合格的分散单细胞是流式细胞术样本制备技术中重要的一环。它既要求组织分散成为单个细胞,又要维持细胞的固有生物化学成分及生物学特性。
一、流式细胞术样本制备的基本原则
- 保证各种液体和悬浮细胞样本新鲜,尽快完成样本制备和检测。
- 针对不同的细胞样本进行适当洗涤、酶消化或者 EDTA 处理,以清除杂质,使黏附的细胞彼此分离形成单细胞状态。
- 对新鲜实体瘤组织可选用酶消化法、机械打散法或化学分散法来获得足够数量的单细胞悬液。
- 对石蜡包埋组织应先切成若干 40~50μm 厚的蜡片,经二甲苯脱蜡至水后,再用前述方法制备单细胞悬液。
- 单细胞悬液的细胞数不少于 107个/mL。
二、流式细胞术实验操作大致分为以下五个步骤
- 取材:取手术或活检组织必须具有代表性,如取手术肿瘤组织,必须取肿瘤细胞生长旺盛部位;组织等标本必须在取材后保持样本的新鲜;一般在室温1个小时内处理好样本或及时用固定剂或低温对组织进行保存。
- 对细胞的待测生物化学成分进行荧光染色。
- 按照厂家提供的软件程序对样本进行获取、检测和存储。
- 依照软件提供的程序对检测结果进行定性定量分析。
- 检测分析结果在生物、医学上的意义进行分析和评价。
三、外周血液标本的制备
a)常规血液样本制备
- 采集外周血,用肝素抗凝;采集后室温(25℃)保存,6 h 内处理;
- 红细胞裂解液(ACK buffer)取出后,恢复至室温待用;
- 流式管内加入 200 ul 外周血后,加入 3 mL 的 ACK buffer,室温孵育 3~5 min;
- 加入 10 mL 细胞染色buffer(或含 1%BSA 的 PBS)终止红细胞裂解;
- 300 g 离心细胞悬液 5 分钟,弃掉上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)重复洗涤一次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL 备用。
b)外周血单个核细胞样本制备
- 采集外周血 2 mL,用肝素抗凝,用生理盐水将血液稀释成 4 mL,混匀;
- 15 mL 的离心管内,先加入等体积(4 mL)的淋巴细胞分离液;
- 将稀释后的外周血沿管壁缓慢加入淋巴细胞分离液的液面上,勿用力过大,以免造成血液与分离液混合。务必保持清晰的分层状态;
- 400 g 室温离心 20~30 min(根据血液样本量确定离心条件,建议先摸索一下条件以达到最好的分离效果);离心后可见试管内血液清晰的分为4层,上层为血浆层,第二次为白色淋巴细胞层,第三层为透明分离液层,底层为红细胞层;
- 用吸管将第二层的淋巴细胞层小心的吸出收集到另 1 试管,用细胞染色 buffer(或含 1%BSA 的 PBS )清洗 2 遍,每次 250 g 离心 10 min;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL 备用。
四、 骨髓细胞样本制备
a)常规骨髓细胞样本制备
- 无菌抽取骨髓液 0.5 mL,用肝素抗凝;
- 红细胞裂解液(ACK buffer)取出后,恢复至室温待用;
- 骨髓液中加入 3 mL 的 ACK buffer,室温孵育 3~5 min;
- 加入 10 mL 细胞染色 buffer(或含1%BSA的PBS)终止红细胞裂解;
- 300 g 离心细胞悬液 5 分钟,弃掉上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)重复洗涤一次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL 备用。
b)骨髓液单个核细胞样本制备
- 无菌抽取骨髓液 0.5 mL;
- 将骨髓液标本中滴入含 1000 U/mL 肝素抗凝剂的 1 mL PBS 液中;
- 加入 PBS 稀释液将样本稀释至 10 mL;
- 15 mL 的离心管内,先加入 5 mL 的淋巴细胞分离液;
- 用吸管吸取 5 mL 的稀释后的骨髓液缓慢沿管壁加入淋巴细胞分离液的液面上;
- 400 g 室温离心 20~30 min(根据骨髓样本量确定离心条件,建议先摸索一下条件以达到最好的分离效果);离心后可见试管内骨髓液清晰的分为 4 层,上层为 PBS 稀释液层,第二层为白色淋巴细胞层,第三层为透明分离液层 ,第四层为红细胞层;
- 用吸管将第二层的淋巴细胞层小心的吸出收集到另 1 试管,用细胞染色 buffer(或含 1%BSA 的 PBS)清洗 2 遍,每次300 g 离心 5 min;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL 备用。
五、体液、灌洗液或悬浮培养细胞的制备
- 采集新鲜体液、灌洗液或悬浮培养细胞;
- 300 g 离心 5 min,收集细胞沉淀;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)离心洗涤 1~2 次;
- 若悬液中有明显的沉淀块,需用 200~300 目的滤网过滤后再用细胞染色 buffer(或含 1%BSA 的 PBS)洗涤 1~2 次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整浓度至 1x107/mL 备用。
六、贴壁细胞的制备
- 吸除培养基上清液,用含无钙、镁离子的PBS漂洗一次;
- 以 25 mL 培养基为例,加入 1 mL 消化液(0.1%胰蛋白酶),置室温(25℃)或 37℃ 消化 2~5 min;或者加入 1 mL 的 EDTA(0.02%,pH7.4)冰上静置 5~10 min;
- 在倒置显微镜下观察,发现胞质回缩、间隙加大,立即吸除消化液并加入等倍体积含血清的培养基终止消化;
- 吸取瓶内液体,反复吹打瓶壁细胞。吹打动作要轻柔并尽量避免产生泡沫;
- 转移至离心管,300 g 离心 5 min,弃上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)离心洗涤 1~2次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS )调整细胞浓度至 1x107/mL 备用。
七、组织标本的制备
a)剪碎研磨法:
- 将组织用 PBS 或无血清培养基漂洗干净;
- 将组织置于平皿中,用眼科剪剪成小颗粒(1~2 mm3);
- 用注射器针芯研磨成匀浆;
- 滴加适量的 PBS 或无血清培养基,用移液器吹打混匀;
- 经 200~300 目滤网过滤,300 g 离心 5 min,弃上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)离心洗涤 1~2 次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL备用。
b)网搓法
- 将 300 目尼龙网扎在小烧杯上;
- 把剪碎的组织放在网上,以眼科镊子轻轻搓组织块,边搓边加PBS冲洗,直至将组织搓完;
- 收集细胞悬液,300 g 离心 5 min,弃上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)离心洗涤 1~2 次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL 备用。
c)研磨法
- 将组织剪成 1~2 mm3 大小的组织块;
- 放入组织研磨器中,加入 1~2 mL 的 PBS;
- 转动研棒,研至匀浆;
- 加入 10 mL 的 PBS,冲洗研磨器;
- 收集细胞悬液,经 200~300 目尼龙网过滤,300 g 离心沉淀 5 min,弃上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)离心洗涤 1~2 次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL 备用。
注意:1)以上方法为机械法,用于处理部分软组织例如胸腺、淋巴结等,对硬组织或纤维组织效果不好,并且对组织细胞有一定的损伤。
2)若组织为脾脏,可用研磨法处理后做红细胞裂解。在 300 g 离心沉淀 5 min 弃上清后,加入 3 mL 的 ACK buffer,室温孵育 3~5 min;再加入 10 mL 细胞染色 buffer(或含 1%BSA 的 PBS)终止红细胞裂解;后续操作同研磨法。
d)胰蛋白酶消化法:
适用于消化间质较少的组织,如上皮、肝、肾等组织,由于钙离子或血清会抑制胰蛋白酶的消化作用,此过程中使用的液体应不含这些离子或血清。消化时间根据不同情况进行调整,温度低、组织块大、胰蛋白酶浓度低,消化时间长;反之则缩短消化时间。胰蛋白酶常与 EDTA(0.02%)等比例混合使用可提高消化效率。
- 将组织块用无钙、镁离子的 PBS 漂洗干净;
- 将组织置于平皿中,用眼科剪刀剪成小颗粒(1~2 mm3);
- 加入 30 倍组织量的蛋白酶溶液(0.1% 胰蛋白酶和 0.02%EDTA 等比混合);
- 移液管转至三角烧瓶,置于37℃水浴或者恒温箱中消化 20~60 min,每隔5~10 min震荡一次。若需消化较长时间,可每隔 15 min 将 2/3 的消化上清液转移到离心管中冰浴或离心去除消化液,加入含血清培养基终止消化,另补充新的消化液至三角烧瓶中继续消化;
- 将消化液或分批收集的细胞悬液经 200~300 目的滤网过滤,300 g 离心 5 min,弃上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)离心洗涤 1~2 次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL 备用。
e)胶原蛋白酶消化法:
此法适用于分离纤维性组织、上皮及癌组织。钙、镁离子不会抑制消化作用,因此可用PBS或含血清培养基配制以提高细胞成活率。
- 将组织块用PBS漂洗干净;
- 将组织置于平皿中,用眼剪刀剪成小颗粒(1~2 mm3);
- 加入30倍组织量的蛋白酶溶液(0.1~0.3μg/mL 的胶原蛋白酶);
- 移液管转至三角烧瓶,置于 37℃ 水浴或者恒温箱中消化 4~48 h,每隔 5~10 min 震荡一次。亦可每隔 15 min 将2/3 的消化上清液转移到离心管中冰浴或离心去除消化液,加入含血清培养基终止消化,另补充新的消化液至三角烧瓶中继续消化;
- 将消化液或分批收集的细胞悬液经 200~300 目的滤网过滤,300 g 离心 5 min,弃上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)离心洗涤 1~2 次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL 备用。
注意:以上几种为最常见的实体组织样本单细胞制备方法,机械法常常造成严重的细胞损伤,单细胞产量低;酶学法、化学法(酶和EDTA结合使用)对实体组织的分散解聚较理想,但对所测细胞化学成分可能存在不良影响,所以需结合实验目的选择合适的单细胞悬液制备方法。
八、石蜡包埋组织的流式细胞样本制备
外科手术获得的实体组织,大部分经过石蜡包埋处理。石蜡包埋组织单细胞分散方法的建立,扩大了流式细胞术的应用范围。
- 将石蜡包埋组织切成 40~50μm 厚的组织切片 3~5 片,或者用乳钵研成 0.5 mm 直径大小的颗粒,放入 10 mL 的试管中;
- 加入 5~8 mL 二甲苯,室温下脱蜡 1~2 天,视石蜡脱净与否,更换 1~2 次二甲苯,石蜡脱净后,弃去二甲苯;
- 水化:依次加入 5 mL 的 100%、95%、70%、50% 梯度乙醇,每次 10 min;
- 去乙醇,加入蒸馏水 3~5 mL,10 min 后弃之;
- 消化:可加入 2 mL 的 0.5% 胰蛋白酶(pH1.5~2.0)消化液,置于37℃恒温水浴中消化 30 min,在此期间,每隔 10 min 用振荡器震荡 1 次;
- 消化 30 min 后,加入含血清培养基终止消化;
- 经 300 目尼龙网过滤,未消化好的组织可进行第二次消化;
- 收集细胞悬液,300 g离心5 min,弃上清;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)离心洗涤 1~2 次;
- 用细胞染色 buffer(或含 1%BSA 的 PBS)调整细胞浓度至 1x107/mL备用。
注意事项:
- 新鲜组织标本应及时进行处理保存,以免组织在室温下放置时间过长,产生中心组织坏死或者细胞自融,影响 FCM 测定结果;
- 酶学法要注意条件的选择和影响因素,同时注意酶的溶剂、消化时间、pH 值、浓度等方法对酶消化法的影响;
- 不同的实体组织应选取不同的制备方法,如富含细胞的组织----淋巴肉瘤、视神经母细胞瘤、脑瘤、未分化瘤、髓样瘤以及一些软组织肉瘤等,用单纯的机械法就可以获得大量高质量的单分散细胞;
- 在使用酶学方法时,应重视酶的选择,如含有大量结缔组织的肿瘤----食管癌、乳腺癌、皮肤癌等,应选用胶原酶消化。



![2,4-二氯-1-萘酚[用于照相技术],2050-76-2,≥97%(GC)(T),阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/923/2131019441498633081.jpg!wh200)