流式细胞术实验
最新修订时间:
原理
材料与仪器
步骤
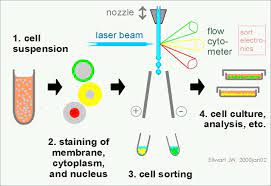
一、单细胞悬液制备方法
流式细胞术的分析检测建立在单个细胞的基础上,制备合格的单个分散的细胞悬液是非常关键的一环。对不同来源和不同形式的样品,根据各种样品的特点可选择不同的分散方法。
1. 单层培养细胞、血液、各种脱落细胞等样品,标本经过简单的制备悬液,离心分离处理,就可以得到分散较好的单个细胞悬液,是理想的流式细胞术检测对象。
2. 对于不同组织来源的实体组织标本,采用酶消化法、机械法和化学试剂处理法来分散细胞。
3. 石蜡包埋组织单细胞悬液的制备,可使大量存档的临床资料重新得到研究与利用,从而扩大了流式细胞术的应用范围。样品制备一般通过切片、脱脂、水化、消化及终止消化后过滤再收集细胞悬液,去除碎片的单细胞悬液用70%乙醇固定保存。
二、检测细胞周期各时相的细胞百分数
1. 培养或分离的细胞约为1×106,离心沉淀后用0.3ml含10%小牛血清的PBS悬浮,移入1.5ml EP管中,加入0.7ml无水乙醇,置-20℃下固定24h以上。
2. 3000 r/min离心30s,弃上清液,用lml PBS重悬细胞,再离心洗涤细胞一次。
3. 弃上清液,沉淀细胞用100μl 1mg/ml RNase A悬浮,37℃下放置30min。
4. 加入400μl 50μg/ml PI,置暗处10min。
5. 最后用流式细胞仪测定。
根据流式报告中给出G0/G1、S、G2/M各期细胞的百分比、凋亡百分比和细胞倍体进行实验分析。
三、流式细胞仪检测细胞凋亡(Heochst 33342/PI双染色法)
1. 悬浮生长的细胞在培养的状态下加入Heochst 33342,终浓度为l μg/ml;37℃培养箱孵育7——10min。
2. 500——1000 r/min低温离心5min,弃去染液。
3. 加入1.0ml PI染液,4℃避光染色15min。
4. 400目的筛网过滤1次。
5. 流式细胞仪检测分析。
四、结果观察
1. 根据流式报告中给出的G0/G1、S、G2/M各期细胞的百分比、凋亡细胞百分比和细胞倍体进行实验分析。
2. 细胞凋亡观察
Heochst 33342用氪激光激发的紫外线荧光,激发光波波长为352nm,发射光波波长为400——500nm,产生蓝色荧光;PI用氩离子激光激发荧光,激发光波长为488nm,发射光波长大于630nm,产生红色荧光。分析蓝色荧光对红色荧光的散点图或地形图。
3. 结果判断
在蓝色荧光对红色荧光的散点图上,正常细胞为低蓝光/低红光,凋亡细胞为高蓝光/低红光,坏死细胞为低蓝光。
注意事项
2. 细胞活性要好,否则易发生非特异性荧光染色。
3. 确保标本上机检测前的细胞浓度为1×106/ml,细胞浓度过低则直接影响检测结果。
4. 操作方面,保证流式细胞仪在整个工作过程中处于最佳状态,能保证定量检测的准确性和检测精度。使用标准样品调整仪器的变异系数在最小范围,分辨率在最好状态,能避免在测量过程中仪器条件的变化引起的检测误差。
5. 在红色荧光对蓝色荧光散点图上,还可见到细胞凋亡区向细胞坏死区迁移的轨迹,可能是凋亡细胞的DNA进一步降解的缘故。
6. 用Heochst 33342染料与细胞孵育的时间不宜过长,一般控制在20min之内为宜。如果太长可引起Heochst 33342的发射光谱由蓝光向红光的迁移,导致红色荧光与蓝色荧光的比例改变,从而影响结果的判断。
常见问题
5. 在红色荧光对蓝色荧光散点图上,还可见到细胞凋亡区向细胞坏死区迁移的轨迹,可能是凋亡细胞的DNA进一步降解的缘故。
6. 用Heochst 33342染料与细胞孵育的时间不宜过长,一般控制在20min之内为宜。如果太长可引起Heochst 33342的发射光谱由蓝光向红光的迁移,导致红色荧光与蓝色荧光的比例改变,从而影响结果的判断。
来源:丁香实验