Transwell侵袭实验总结之操作步骤
互联网
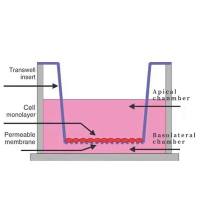
一、Transwell小室制备
1. 无基质胶Transwell小室制备
① 包被基底膜:
用50 mg/LMatrigel 1:8稀释液包被Transwell小室底部膜的上室面,4 ℃风干。如果需要在下室面铺FN的话,可将200 ul枪头的尖端剪掉,吸取FN均匀涂抹在小室的下面。用胶原(collagen)的话,一般配成0.5 mg/ml,直接用枪吸了涂在膜上。
② 水化基底膜:
吸出培养板中残余液体,每孔加入50ul含10g/LBSA的无血清培养液,37 ℃,30min。另有tianjin_glioma战友提供的方法:在上室的聚碳酸酯膜上加入稀释后的Matrigel (3.9 ug/ul) 60-80 µl (注意体积不可太大,以刚把聚碳酸酯膜浸湿为最好),置37 ℃ 30 min使Matrigel聚合成凝胶。
2. 有基质胶的Transwell小室制备
Chemicon公司的ECM550系列说明书要求,将小室放入培养板中,在上室加入300 µl预温的无血清培养基,室温下静置15-30 min,使基质胶再水化。再吸去剩余培养液。
二、制备细胞悬液
① 制备细胞悬液前可先让细胞撤血清饥饿12-24 h,进一步去除血清的影响。但这一步并不是必须的。
② 消化细胞,终止消化后离心弃去培养液,用PBS洗1-2遍,用含BSA的无血清培养基重悬。调整细胞密度至1-10×105,个人认为不要超过5×105。具体实验时采用密度要自己摸索,因为不同细胞,其侵袭能力是不同的。
个人经验,细胞量过多,穿过膜的细胞会过多过快,如果最后用计数法统计结果的话将难以计数;而过少的话,可能还没到检测的时间点,所有的细胞都已穿过,因此最少也要保证在收样的时候,上室内还要有一定量的细胞存在。个人认为,对照组和处理尽量不要分开计数,因为细胞数目的差异会严重影响实验结果。如果需要对细胞预处理而不得不分开计数,那么计数一定要多重复几次,力求准确,尽量保证对照组和处理组细胞密度一致。
三、接种细胞
① 取细胞悬液100-200 µl加入Transwell小室,不同公司的、不同大小的Transwell小室对细胞悬液量有不同要求,请参考说明书。24孔板小室一般200 µl。
② 24孔板下室一般加入500 µl含FBS或趋化因子的培养基,不同的培养板加的量有不同要求,具体请参考说明书。这里要特别注意的是,下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。
③ 培养细胞:常规培养12-48 h(主要依癌细胞侵袭能力而定)。时间点的选择除了要考虑到细胞细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。
以我的课题为例,我使用的药物不仅会抑制肿瘤细胞侵袭力,还对细胞增殖有明显抑制。我选择的药物浓度是用MTT筛选出的72 h的IC50。用这个浓度处理细胞,24 h内对细胞增殖并无明显抑制,但24 h后,抑制作用就开始出现了。所以,用这个浓度来做Transwell,处理时间也必须限定在24 h内,否则一旦药物抑制了细胞增殖或者诱导出凋亡,使处理组细胞数目少于对照组,那么就难以肯定穿过膜的细胞比对照组少,究竟是由于侵袭被抑制引起,还是处理后细胞数目本身就比对照组少而引起的了。
时间过长不可以,同样,过短也不行,因为细胞内会有一定量的MMPs储存,短时间内可能侵袭能力不会有太大改变。同时从药物被吸收进去,进而发挥作用,影响MMPs表达,到最后释放到培养基中,还需要一个过程。时间点的选择可尽量长点,也可选择多个时间点研究时间依赖效应,但前提是这个时间范围内细胞数目不能有明显变化。另外,我看到细胞在小室内的形态不是正常培养贴壁的形态,而是圆形的,仍是悬浮时的形态,不过会聚集成团,所以看到细胞不正常贴壁也不要紧张,是正常现象
在培养过程中,膜下会逐渐有少量小气泡产生,这是正常现象,可不予处理,但我遇到过培养一段时间后,膜下出现了大气泡,幸亏及时发现,否则后果将非常严重。因此,个人建议,最好接种细胞后1-2 h把培养板从培养箱里拿出来看看,确信没有大气泡产生。
四、结果统计
检测穿过的细胞数有两种方法:
1. 直接计数法
(1)“贴壁”细胞计数
这里所谓的“贴壁”是指细胞穿过膜后,可以附着在膜的下室侧而不会掉到下室里面去。
通过给细胞染色,可在镜下计数细胞
① 用棉签擦去基质胶和上室内的细胞
② 染色:常用的染色方法有结晶紫染色、台�蓝染色、Giemsa染色、苏木精染色、伊红染色等。个人推荐采用0.1%结晶紫染色,这种方法有如下优势:(1). 不需要固定细胞,直接染色即可。(2). 配制简单方便。(3). 染色后可以用33%醋酸脱色,将结晶紫完全洗脱下来,洗脱液可在酶标仪上570 nm 测其OD值,间接反映细胞数。个人认为这是结晶紫染色最大的优势所在。因为,虽然经过准确的细胞计数,往往穿过膜的细胞数仍难以准确控制,可能某一批实验穿过的细胞会特别多,以致细胞成堆,这种情况下就难以计数了,这种情况下就可以用醋酸脱色后用酶标仪检测。使用结晶紫染色要注意,染色前要将膜风干,否则可能会染不上。
③ 细胞计数:我们使用的是Leica DC 300F正置显微镜进行观察和拍照,把Transwell小室反过来底朝上就可清楚看到小室底膜上下室侧附着的细胞。也有不少人用手术刀将膜切下后染色,再贴在玻片上,滴二甲苯,再盖上盖玻片,就可以长期保存,但是这样做小室就成了一次性的了,未免有点浪费。
取若干个视野计数细胞个数。论坛里一般采用3-5个视野,也有人用10个,都是随机选取,个人认为这样选择的视野带有很大的偶然性,也会掺进人为影响,特别是计数视野较少的时候。我选取16个视野,不是随机选择,而是有固定的位置。我们使用的显微镜所看到的视野的直径刚好是Chemicon公司的ECM550系列小室底面膜的直径的1/4。不同厂家不同型号的小室,膜的面积不尽相同,但个人认为,拍照时还是应当选取固定的位置,并选择尽可能多的视野。
(2)“非贴壁”细胞计数
由于某些细胞自身的原因或某些膜的关系,有时细胞在穿过膜后不能附着在膜上,而是掉进下室。这种情况我没有遇到过,根据论坛里提供的经验,可以收集下层培养液,用流式细胞仪计数细胞量,也可用细胞计数的方法直接在镜下计数,个人认为MTT应该也是可以用的,有兴趣的可以试试看。
2. 间接计数法
间接计数法主要用于穿过细胞过多,而无法通过计数获得准确的细胞数所采用的方法,与常用的MTT实验是同样的原理。
(1)MTT法
① 用棉签擦去基质胶和上室内的细胞
② 24孔板中加入500 µl含0.5 mg/ml MTT的完全培养基,将小室置于其中,使膜浸没在培养基中,37 ℃ 4 h后取出。
③ 24孔板中加入500 µl DMSO,将小室置于其中,使膜浸没在DMSO中,振荡10 min,使甲�充分溶解。取出小室,24孔板于酶标仪上测OD值。
(2)荧光试剂检测
这类方法一般是与Transwell小室一起出售的,其原理与MTT法类似,是用一种荧光染料染细胞,再将细胞裂解,检测荧光值。Chemicon的ECM554即属于这类。
(3)结晶紫检测
上文已说过,这里不再赘述,原理与MTT法也是类似的。但结晶紫染色还有个优点,就是染色和脱色的过程并不影响膜上细胞,在脱色后还可重新染色