Transwell 侵袭实验总结
丁香园
我的课题涉及 Transwell 侵袭实验,因此在这里和大家分享 Transwell 侵袭实验。
实验用品
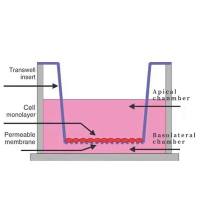
1.Transwell 小室
我用的是 ECM554,用完后擦去基质胶,再用胰酶和 75% 酒精泡,可以把膜洗得很干净,用前用紫外里外都照 30 min。处理方法:用棉签轻轻擦去胶和反面细胞,清水冲洗,超声清洗,低档,30 min,清水 3×5 min,蒸馏水 3×5 min,室温凉干,用前紫外线小室正面 3 h,反面 6 h,微波,低火 10 min×2。
因为我买的是铺好胶的,所以没买 Matrigel,二次利用的小室只用来做不需要铺胶的迁移实验。以前的 Chemicon ECM550 系列,膜很结实,擦不坏,可以反复用很多次。
Transwell 小室用过后,可把原来的膜切下,贴上 osmonic 公司的膜,这样又可以用了,有兴趣的可以试试。使用方法:trasnwell 小室做一次后,将原来的膜去掉,重新泡酸,泡酒精,使用前照紫外,然后用女士用指甲油(注意用无色较稀的)将 osmonic 公司的膜贴上,剪掉多余的边缘。再照紫外。
2.上层培养液
上层培养液采用无血清培养基,为维持渗透压,需加入 0.05%-0.2% BSA。
3.细胞
有侵袭能力的细胞才可用于 Transwell 侵袭实验。建议实验前先用酶谱法检测 MMPs 的表达,特别是 MMP-2 的表达。如果不清楚细胞 MMPs 的表达情况,就盲目进行 Transwell 侵袭实验,可能会造成不必要的浪费。
另外,为了让实验结果更明显,可先撤血清让细胞饥饿 12-24 h,再进行实验。
4.基质胶
常用的是人工重构基底膜材料 Matrigel,主要成分为层黏连蛋白和 Ⅳ 型胶原。Matrigel 是一种细胞外基质,4℃ 时是液体,在 37℃ 会逐渐凝固成胶状,不可逆。同样的东西在 sigma 叫 ECM。如果购买的小室是已经铺好基质胶的,那么 Matrigel 就不需要购买了。
5.下层培养液
下层常用含 5%-10% FBS 的培养基,具体浓度根据细胞侵袭力而定,侵袭力弱的细胞可适当提高 FBS 浓度。下层也可用趋化因子,也可将将纤维粘连蛋白加入下层培养液作为趋化因子,但我认为 FBS 仍是最合适的。
6.细胞培养板
常用于 Transwell 侵袭实验的细胞培养板有6 孔板、12 孔板、24 孔板等,以 24 孔最常用。需注意,细胞培养板应当与购买的 Transwell 小室相配套。
7.相关信息
此外,膜的下室面可涂上纤维粘连蛋白(fibronectin,FN,Sigma有售),这样做的目的是使穿过膜的细胞更好地附着在膜上,也可用胶原(collagen)或明胶(gelatin)。
很多人认为这不是必须的,而且我也是不涂的,细胞照样贴壁很好。如果贴壁不好的话可以试试看。也有人认为,如果培养时间很长(>24 h),细胞还是会掉到下室里面去,所以有条件的话,最好还是在膜下层涂上 FN。
另外,膜下层涂上 FN 还有一定的趋化作用。
实验步骤
1.Transwell 小室制备
用 50 mg/L Matrigel 1:8 稀释液包被 Transwell 小室底部膜的上室面,4℃ 风干。如果需要在下室面铺 FN 的话,可将 200 μL 枪头的尖端剪掉,吸取 FN 均匀涂抹在小室的下面。用胶原(collagen)的话,一般配成 0.5 mg/mL,直接用枪吸了涂在膜上。
另一方法:在上室的聚碳酸酯膜上加入稀释后的 Matrigel(3.9 μg/μL)60-80 μL(注意体积不可太大,以刚把聚碳酸酯膜浸湿为最好),置 37℃ 30 min 使 Matrigel 聚合成凝胶。
按照 ECM550 系列说明书要求,将小室放入培养板中,在上室加入 300 μL 预温的无血清培养基,室温下静置 15-30 min,使基质胶再水化,再吸去剩余培养液。
2.制备细胞悬液
1. 制备细胞悬液前可先让细胞撤血清饥饿 12-24 h,进一步去除血清的影响。但这一步并不是必须的。
2. 消化细胞,终止消化后离心弃去培养液,用 PBS 洗 1-2 遍,用含 BSA 的无血清培养基重悬。调整细胞密度至 1-10×100 000,个人认为不要超过 5×100 000。
具体实验时采用密度要自己摸索,因为不同细胞,其侵袭能力是不同的。细胞量过多,穿过膜的细胞会过多过快,如果最后用计数法统计结果的话将难以计数。而过少的话,可能还没到检测的时间点,所有的细胞都已穿过,因此最少也要保证在收样的时候,上室内还要有一定量的细胞存在。
对照组和处理组尽量不要分开计数,因为细胞数目的差异会严重影响实验结果。如果需要对细胞预处理而不得不分开计数,那么计数一定要多重复几次,力求准确,尽量保证对照组和处理组细胞密度一致。
1. 取细胞悬液 100-200 μL 加入 Transwell 小室,不同公司的、不同大小的 Transwell 小室对细胞悬液量有不同要求,请参考说明书。24 孔板小室一般 200 μL。
2. 24 孔板下室一般加入 500 μL 含 FBS 或趋化因子的培养基,不同的培养板加的量有不同要求,具体请参考说明书。这里要特别注意的是,下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。
3. 培养细胞:常规培养 12-48 h(主要依癌细胞侵袭能力而定)。时间点的选择除了要考虑到细胞细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。
以我的课题为例,我使用的药物不仅会抑制肿瘤细胞侵袭力,还对细胞增殖有明显抑制。我选择的药物浓度是用 MTT 筛选出的 72 h 的 IC50。用这个浓度处理细胞,24 h 内对细胞增殖并无明显抑制,但 24 h 后,抑制作用就开始出现了。
所以,用这个浓度来做 Transwell,处理时间也必须限定在 24 h 内,否则一旦药物抑制了细胞增殖或者诱导出凋亡,使处理组细胞数目少于对照组,那么就难以肯定穿过膜的细胞比对照组少,究竟是由于侵袭被抑制引起,还是处理后细胞数目本身就比对照组少而引起的了。
时间过长不可以,同样,过短也不行,因为细胞内会有一定量的 MMPs 储存,短时间内可能侵袭能力不会有太大改变。同时从药物被吸收进去,进而发挥作用,影响 MMPs 表达,到最后释放到培养基中,还需要一个过程。
时间点的选择可尽量长点,也可选择多个时间点研究时间依赖效应,但前提是这个时间范围内细胞数目不能有明显变化。
另外,我看到细胞在小室内的形态不是正常培养贴壁的形态,而是圆形的,仍是悬浮时的形态,不过会聚集成团,所以看到细胞不正常贴壁也不要紧张,是正常现象。
在培养过程中,膜下会逐渐有少量小气泡产生,这是正常现象,可不予处理,但我遇到过培养一段时间后,膜下出现了大气泡,幸亏及时发现,否则后果将非常严重。
作者:丁香园站友 lwjssry