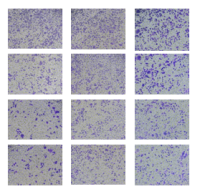
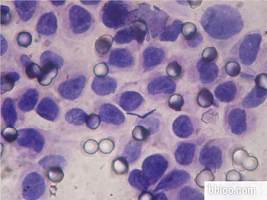
transwell细胞侵袭
dxy_y73o3od5
康宁的8μm小室,每个小室加了300μl的细胞悬液(细胞密度为3x104个/ml),培养24h后,吸去小室内液体,pbs洗两次,100%甲醇固定细胞20min。但是固定细胞的时候发现下室内出现许多白色絮状物,还在不停滚动。我怀疑是甲醇直接杀死了侵袭过膜的细胞,结晶紫染完色果然看不到细胞。有大神能解答一下吗?甲醇固定了后为什么细胞脱落?用什么试剂固定细胞最合适?固定细胞有什么小技巧?恳请答疑
分享
4 个回答
z流沙z
有帮助1
常用冰的4%多聚甲醛,pbs洗的时候轻柔一点
土井挞克树
有帮助1
适当降低甲醇的浓度和作用时间。
loveliufudan
有帮助1
甲醇固定是常用的细胞固定方法之一,但是甲醇的使用需要注意以下几点:
甲醇需要使用冰冻的,预先冷却的。这是因为甲醇易于蒸发,蒸发时会吸收周围的热量,导致温度降低,使细胞膜破裂,细胞脱落。
固定时间不要过长,20分钟已经足够。
固定前应用PBS进行洗涤,去除培养液中的蛋白质和细胞因子等,避免对细胞造成伤害。
固定后可以用PBS再次洗涤,以彻底去除甲醇。
其他可选的固定剂包括4%的多聚甲醛,PFA等。
在使用甲醇固定的时候,建议将甲醇放在一个干燥的容器中,以避免甲醇吸收空气中的水分而降低其浓度,这也可以减少细胞脱落的可能性。
最后,如果您的细胞在使用甲醇固定后仍然出现脱落,可以尝试使用其他固定剂,如多聚甲醛或PFA,或调整固定时间、温度等参数,以优化固定条件。
balalaLy
有帮助
一般用甲醇和多聚甲醛固定都可以
相关产品推荐
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序