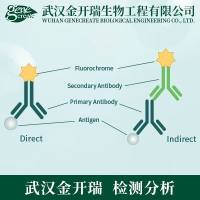
流式、WB、RT-PCR等实验所需细胞数问题
互联网
1、流式所需细胞数
问:我目前准备做流式,要做10 个标本,但是细胞总数不多了,我能不能把原来在100ml培养瓶培养的细胞转移到25ml里培养,这样把细胞重悬后,1个100ml的可以分到4个25ml里。请问这样可以嘛?细胞数够嘛?据说做流式至少要105次方个细胞以上才行。
丁香网友漂泊认为:细胞数是够的,请问你用流式测什么指标,用不用其他药物处理,说得详细点方可知你的方法妥不妥
问:我要用流式测细胞周期,要加抑制细胞增殖的药物,然后自加药的不同时间取样测细胞周期。这样可行不?
丁香网友漂泊认为:抑制率大概多少?那就建议您至少用50ML的培养瓶
问:请教大家一个问题:因为我做流式需要做很多次,就想到用六孔板做,六孔板的一个孔内的细胞数够不够做一次流式用?有没有人用过这个方法?请大家给个建议。
丁香网友venchao认为:足够了, 流式标准一个指标需要1X105。我做过,无有问题
问:因为我做流式需要做很多次,就想到用六孔板做,六孔板的一个孔内的细胞数够不够做一次流式用?有没有人用过这个方法?请大家给个建议。
丁香网友zhaoyihenglk认为:足够了!流式检测所需的细胞的数量级105,而六孔板长满能达106。
问:请问用96孔板作的转染可以做流式细胞仪分析么?做流式细胞仪分析要用多少微升的悬液?谢谢!
丁香网友zhaoyihenglk认为:一般我们使用500微升的悬液上机检测!!!
问:请问流式检测的最小的细胞数量是多少,如果小于一个细胞的话是否就不能采用流式检测了。流式要求的细胞的最小体积是多少,我最近收集了少量细胞团,30-50 微米,因为将细胞团中的各个细胞分离开较难,是否可以用于流式的检测?
丁香网友XTYang认为:如果不能将细胞分散成单个细胞悬液的话是无法用流式细胞法分析的。
丁香网友swarm认为:检测时最少要有2000个细胞,但最初准备样品时,如果只做外标,样品比最少细胞数大一个数量级即可;但要是需要作内标的话,固定液和穿膜液粘度大,细胞损失也多,而且,穿膜液一般对细胞还有损伤,故样品细胞数要比最少细胞数大2个数量级!做流式,细胞必须是单细胞悬液,成团细胞可用胰酶处理,或是在细胞样品中加2mM的EDTA,防螯合。
问:请问流式检测的最小细胞数是多少?如分离出两种细胞,一种细胞数很少,但体积很大,另一种细胞是其数量的10-20倍,是否可以用流式同时检测呢?
丁香网友XTYang认为:记得有人研究用针头取样后进行流式分析的文章,所以细胞数应该是可以很少的.在大量细胞中检测低频率事件(即你例子中的第一种细胞)正是流式的优点.关键是你的第一种细胞在大小,密度或荧光标记上和其他大量细胞有区别,并且细胞团能用酶解或机械方法处理成单细胞悬液.
问:流式能检测含多种细胞的标本吗?细胞碎片影响流式检测效果吗?怎样在检测前去除细胞碎片?
丁香网友swarm认为:能检测含多种细胞的标本因为流式本身能根据细胞的大小及细胞内容物颗粒大小(即所谓的流式仪所用的前向光和侧向光)来区别不同的细胞群而通常做研究时是荧光标记你感兴趣的亚群进行分析含有碎片会有一点点影响,但用空白样品(未作任何荧光标记的样本)选定你想研究的细胞群体时,即可排除细胞碎片,因为碎片所反映的前向光和侧向光和完整的细胞基本不相同 。
2、Western和RT-PCR所需细胞数
问:我是实验新手,拟在细胞上行WB和RT-PCR,由于实验基础太差,不知道细胞水平行WB和RT-PCR所需多少细胞,一般用多大的板子培养才能提足所需蛋白和RNA,请园子里的朋友们不吝指教,多谢!
丁香网友zhangyuelin1999认为:我做过WB的,细胞数目要达到1undefined6个,这样提出的蛋白就可以了!因此一般的六孔板就可以了!24孔板,96孔的感觉有点小了,空间太小细胞长就不好了!先前要计个数的,然后进行蛋白定量的!悬浮的就直接离心得沉淀,裂解得蛋白的就可以了,贴壁的要用到细胞刮子。RT-PCR就不太清楚了,祝实验顺利!
丁香网友everever认为:看你要养的细胞是哪种了,有的细胞的体积就很小,而有的细胞则铺得很开。做RT-PCR用两步法即先抽RNA经反转录再做PCR一般要用到1ug的总RNA。(1ug经反转录成20ul体系后一般可做至少50次20ul体系的PCR)常规做WB一个孔道上样要10*5个细胞。但也和你的目的蛋白及提取的方式有关。如果是膜蛋白或是某细胞器内分布的蛋白细胞数得增多。你最好和你们实验室做过相关实验的人讨论一下。
问:我初次作RT-PCR 和Western,请教要使用多少转染后的细胞呢?转染效率是多少?瞬时转染是否可以传代呢?对检测有多大的影响?
丁香网友lym569认为:一般转染效率达到50%的话,一个24孔班板的细胞足够做RT-PCR 和Western了,你可以做一个6孔板转染或2个24孔细胞转染.瞬时转染可以传代,但传代后所转染的细胞会越来越少.你传代的目的是什么?如果想稳定表达的话,你应该作稳定转染。
问:你的“一般转染效率达到50%的话,一个24孔班板的细胞足够做RT-PCR 和Western了”是不是可以这样理解:转染效率50%,24孔板上每个孔均长满细胞。一半细胞用作RT-PCR ,另一半用作Western。再弱弱的问:是刚好够吗?您的建议:你可以做一个6孔板转染或2个24孔细胞转染。24孔板2个是为了保险。那6孔板是??
丁香网友lym569认为:转染效率50%,24孔板上每个孔均长满细胞。一半细胞用作RT-PCR ,另一半用作Western 足够用了. 做2孔是其中一孔做RT-PCR ,另一孔做Western,这样操作起来比较方便,一个24孔板上的细胞够你做几次Western了.如果用6孔板,你只转染一个孔就可以,看你喜欢哪种了。
3、MTT细胞数问题
问:本人准备做SKOV3和SMMC-7721的MTT实验,请问MTT实验中96孔板中的合适细胞数或者浓度。
丁香网友rfei8510认为:调整细胞浓度至1×105/ml,分别加入96孔板,每孔加200μL使每孔细胞数目是2×104个。
请教:各位在做MTT时,如何尽量保证各孔细胞数基本一致?混匀细胞所用容器是培养皿还是储液器?储液器用的是一次性的还是可重复使用的,哪家公司的,价格?
丁香网友clearair00认为:MTT检测时各孔细胞数的均一可比是关键。首先要保证收集细胞的分散混匀,贴壁细胞要消化完全,悬浮集落细胞团块要吹散充分,最好显微镜下观察确定。其次微量取液操作要规范、稳定,建议选用精密度较高的微量移液器和质地优良的Tip头。至于混匀细胞的场所是选择培养皿还是储液器,抑或其它容器,应该没有很大的影响,只要方便操作且不影响细胞活力即可灵活选用。额外补充一句,MTT检测结果的影响因素除上面提及的方面外,每孔接种细胞的密度也是保证获取有意义和正确结果的重要一环,具体的接种细胞密度要根据不同的实验目的和观察效应的差异进行调整、确定。
请问做MTT时,96孔板中每孔的细胞数是多少啊?为了照相每次我都在加MTT前将扳子的培养液甩掉,照完相后加70微升的无血清培养液(为了节省)和20微升的MTT,不知道这样对结果有没有影响?
丁香网友偷懒的猪认为:不同的细胞,不同的药物作用时间或是影响因素,要求接种的细胞数会不同。一般是1000-10000个,看你的细胞的生长速度,体积大小,都会有影响的。我做的几个不同的肿瘤细胞系,多数种3000-5000个,药物作用48-72小时是可以的,细胞数太少,读数太低,误差会增大。细胞数太多,细胞长满了以后脱落,OD值和活细胞之间就不再是线性关系了,也会使结果失真。我们这里也有人种1000/孔,但我试过2500/孔,作用48小时,OD值就特别小了。MTT的影响因素太多了,还要自己好好摸索,愿你好运!
我在用MTT法作细胞的生长曲线,现在遇到了几个问题,希望有人能帮我解决。
(1)OD值转换成细胞数的方法?
(2)我得出的OD值都是在2-3之间,准确吗?
(3)我不知道选择哪个波长490和570的,就选了两个?570的值比490的高,我该用哪个值 ?
丁香网友ryochan 认为:
(1)OD值转换为细胞数似乎不太好操作,就像楼上战友说的那样,影响因素比较多,单个细胞活性与MTT转化量是有关系的,所以需要有一个标准细胞活性的参照才能计算细胞数。
(2)OD应该在0.2~1之间线性度最好,2-3就不太好了,有时候<1.5也凑合了。
(3)标准的MTT,DMSO溶的话,吸光度峰值应该在570nm,线性度最高,但是多数实验室酶标仪的滤光片配置都没有这个数值,所以似乎大家就用490nm来替代了,理论上说线性度不如570nm,但是因为相差不算太多,也可以代用。
丁香网友忆歆人认为:可以先通过配制梯度浓度的细胞数,利用MTT法测OD值,将细胞数同OD值之间建立线性关系,即一标准曲线。再根据标准曲线,通过OD查找对应的细胞数!
请教一下细胞数目是怎么调的,我的方法如下:先需7-8X104/ml的细胞浓度,把培养瓶中的细胞消化后,离心,弃去上清液,沉淀中加入少量培养基,制成细胞悬液,另取一预先消毒的大口瓶,加入培养基,所加培养基的量以超过自己所设计的96孔板上所需的接种量少许为宜,然后,用吸管吸取少量悬液,滴入大口瓶中,用玻璃计数板计数,四个大格平均数为7-8个,如果不够,继续滴加初始悬液,最终制成7-8X104/ml的细胞悬液。刚开始做MTT,还不太熟,请大家指教。不知道这种方法对不对?
丁香网友hualey认为方法太复杂了,他的方法:正常消化,观察细胞明显收缩后,倒掉胰酶,用少许培养基轻轻荡洗细胞,弃去培养液,加入少许培养液吹打细胞,使之从壁上掉下,转移至离心管中用直头滴管吹打成单细胞,细胞计数,测得的密度除以所要求的密度,得到要稀释的倍数,稀释。主要不同在于如果先稀释,可能会浪费培养基,至于其它操作,也可能是个人习惯问题,希望对你有帮助。
丁香网友jjw703 认为:调细胞浓度我们做的很多,方法和战友hualey的基本相同。不同的是我们实验室在消毒细胞培养瓶的同时,还消毒一批小的瓶子,从10ml到20ml,这可以用来调细胞浓度。具体方法是消化收集细胞,转入消毒好的小瓶子,然后细胞计数,得到一个原始浓度。根据你所要的浓度的细胞悬液的量来稀释。比如你调的原始细胞浓度是2.4×10 5/ml,需要最终细胞浓度8×10 4/ml 一共10ml,那么你就可以取原始细胞悬液3.3ml于另一个消毒好的小瓶子中,再补加6.7ml培养液。我们的方法,一是可以节省离心管,而是可以节省培养基。另外说个体外话,做MTT一定要细胞悬液浓度均匀,所以接种空板时,每加一排孔,都要混匀,把人为操作的误差减少到最低限度。
问:是否初始浓度的细胞,不用知道具体的体积?
丁香网友wolfskin认为:
(1)贴壁细胞胰酶消化,7-8ml培养基吹打呈单个细胞悬液;
(2)取1.5ml离心管,PBS 450ul,细胞悬液50ul,即稀释10倍后计数;
(3)计算密度,换算所需稀释倍数。
目前在养细胞,加不同刺激因素作用于细胞,通过MTT测OD值,观察刺激因素对细胞活力的影响。但作了很多次,除第一次结果OD值均在1以下,其他都有1点几,2点几,有时甚至高达6.0(此时细胞加了MTT20UL/孔后,上清液就变成混浊紫色),而老板说数值太大,一般OD值应小于1。我每次接种细胞密度大概有3-5x105个/ml,是否密度太大?不知各位战友作MTT数值一般多少?此外,为什么有很多次在我刚加了MTT后有些孔上清就变灰紫色,,抚育4h后更多孔上清变色,都看不清孔底的结晶了,是细胞活力太差还是MTT出现问题?
丁香网友essie2003认为:
(1)密度有点大了,你得OD值偏大应该和细胞数量关系很大,小于等于105左右比较合适。
(2)据国外资料OD570在0.7-1.2之间比较可信,但我们这里做的大多在0.3-1.0之间,很少做到1.0以上。
丁香网友song111jun认为:96孔板接种时密度最好在104-105之间,因为96板每一孔长满时消化下来就105左右,你的接种密度肯定高了,我用5x104/ml接种SW480测的结果还可以。你同时考虑一下你的细胞生长速度,最好在细胞处于对数生长期时检测。
问:用MTT法测细胞生长周期,计算倍增时间时还是需要用到细胞数,那怎样把OD值换算成细胞数呢?
丁香网友martin20032758认为:设对照组的OD值为X,实验组OD值为Y。计数对照组的细胞,取均值Z后,则实验组的细胞数为YZ/X
丁香网友zsc78认为:我用MTT法测过细胞生长周期,在细胞密度低的时候还可以,但当细胞增殖到一定数量时,OD值跟细胞数不成比例。建议细胞不要接种太密,在细胞长满之前结束实验。
4、免疫组化细胞数问题
问:我培养的原代细胞,做细胞组化,可发现,做好后,细胞数目比培养时少了很多(大约只剩下不到一半了)。是什么原因呀? 过程如下:
(1)原代培养的成年大鼠神经细胞(神经元),培养3-4周。
(2)吸去培养液,37度0.01MPBS清洗3次 各5 分钟。
(3)1%多聚甲醛固定30分钟。
(4)封闭液封闭(0.5%Triton X-100、4%羊血清、1%BSA、 PBS配制 ) 室温孵育60 分钟。
(5)加1:500稀释的一抗,4℃湿盒过夜,PBS清洗标本 3次各5分钟。
(6)3%H2O2孵育 10分钟,以消除内源性过氧化物酶,PBS清洗标本 3次 各 5 分钟。
(7)加二抗,室温孵育60分钟,PBS清洗标本3次各 5分钟,
(8)加ABC,室温孵育60分钟,PBS清洗标本3次各 5分钟。
(9)加DAB显色液,显色8分钟,加PBS终止反应。
说明:
(1)我在吸去培养液前,观察了一下细胞,数目很多。等我做的第8步完成时,即在DAB显色前,在观察,发现细胞已经丢失了近2/3了。我每次清洗都是很轻的。基本就固定在一点吸液加液。
(2)我培养细胞时,没有在培养板的孔内放载波片,所以上述操作均在培养板上进行。
(3)我在细胞原代培养过程中,细胞数量没有丢失现象。尽管我仅用5ug/ml的多聚赖氨酸铺板。
丁香网友dongwp认为:31%多聚甲醛固定30分钟应用4%多聚甲醛固定,如果固定不充分,细胞就不能很好的黏附于培养板上,所以在染色的过程中被逐渐洗去?。
问:我们有个技术员告诉我(这个技术员可是在美国NIH做过的)他曾经加过4%的多聚甲醛,但结果细胞全部卷起来了。所以告诉我,多聚甲醛的浓度一定要低!我才加1%的 。
丁香网友dongwp认为:那是因为直接加入冷的固定液,细胞受冷收缩的缘故,并非是因为多聚甲醛的浓度。细胞吸去培养液,37度0.01MPBS清洗3次。加入的多聚甲醛也必须是预温的,然后可以室温或4度固定。
5、透射电镜所需细胞数
问:请问培养细胞做透射电镜所需的细胞数目。
丁香网友散木认为:透射电镜一张片子一般只能看十来个,最多几十个细胞。关键是看你怎么做,做什么。是离心成团后固定、切片,还是做细胞爬片再制片。如果你仅仅是在透射电镜下看一下,只要看到就行的话,则:1、如果你你离心成团后固定、制片,那么细胞数就要多点。10的5次方个细胞能离心成肉眼可见的团。肯定是足够了。2、如果是细胞爬片的话,可以用四分之一的玻片放在24孔板里做。这样的细胞数也足够了。如果你还要比较,或者你要观察的现象的特殊形态出现的机率低的话,则另当别论了,一般最好要多做些。
丁香网友hzbzh0722做过的电镜方法:
(1)收集细胞,如果是贴壁细胞先消化后再收获。预冷的PBS洗一次。
(2)600~800转低速离心5Min,去掉细胞碎片。
(3)PBS重悬,1500离心10Min,使细胞压缩成团,大小以一个芝麻粒大小为宜。这时你可以根据你的细胞数再调整一下。太多或太少都不好。
(4)2.5%的戊二醛固定后送电镜
当然后面的制片由专门做电镜的老师来完成了,好像很复杂,我们自己搞不定的。用的是那种很小的筛网。一般细胞多的时候,一个筛网上的细胞可以达到200个,也就是我们通常说的一张片子上的细胞。对你来说应该足够了吧。
丁香网友jessie2003 认为:
(1)一般来说扫描电镜多用细胞爬片,而投射电镜多将细胞消化(指贴壁细胞)、离心、固定。
(2)具体数目好像也没什么规定,尽量不要少,我记得我做的时候每个样本用25ml的培养瓶长满消化的。
(3)关于固定剂,一定要用电镜专用的戊二醛,我记得当时买的400元左右,当然跟电镜室老师要点也行。