重大突破!甘波谊团队 Nature 首次报道第三种铁死亡抑制机制,提供抗癌新思路
丁香学术
507
细胞死亡与癌症等疾病有着密切关系,在细胞的各式花样死法中,铁死亡(ferroptosis)作为一种新兴的死亡方式,近年来越来越受到大家的关注。
图片来源:站酷海洛 Plus
铁死亡是一种由脂质过氧化引起的细胞死亡方式,是抑制肿瘤生长的关键机制之一。
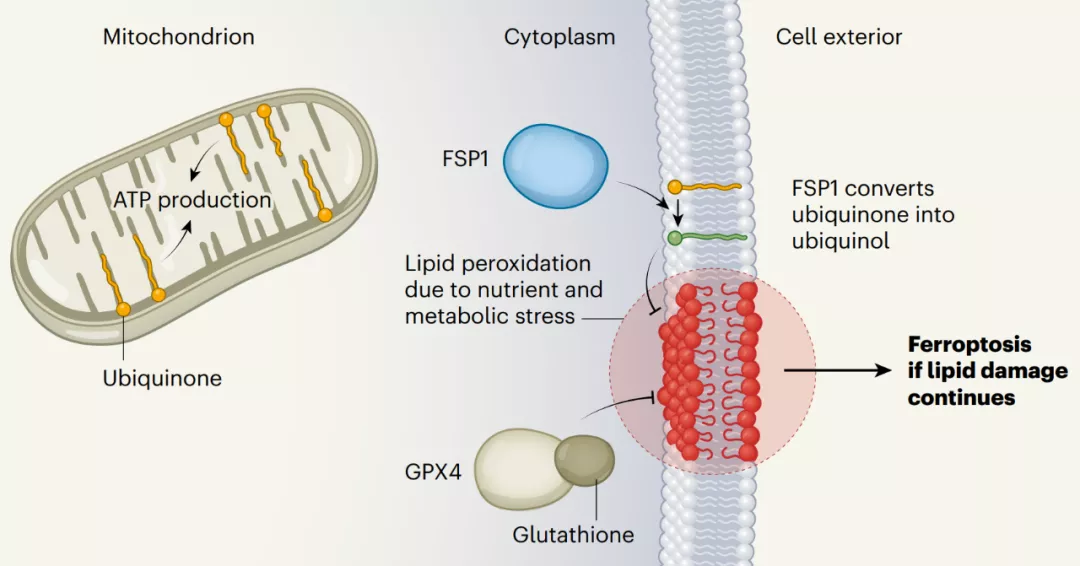
先前的研究发现细胞至少进化出两种防御机制来抑制铁死亡的发生:1) 谷胱甘肽过氧化物酶 4(GPX4)利用还原性谷胱甘肽(GSH)消除脂质过氧化物并抑制铁死亡;2) FSP1(也称为 AIFM2)作为一种氧化还原酶,主要在质膜上将 CoQ 还原为 CoQH2,CoQH2 作为一种抗氧化剂来消除脂质过氧自由基。
然而在其他亚细胞间室中是否存在针对铁死亡的不同防御机制尚不清楚。
图片来源:Nature(1)
2021 年 5 月 12 日,美国 MD Anderson 癌症中心的甘波谊团队和 Kadmon 公司的 Kellen Olszewski 在 Nature 上发表了题为 DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer 的研究成果 (2)。该研究证实了 DHODH 介导的线粒体铁死亡的防御机制,并提出了一种靶向诱导铁死亡的肿瘤治疗新策略。

图片来源:Nature
研究内容
发现:DHODH 可抑制铁死亡的发生
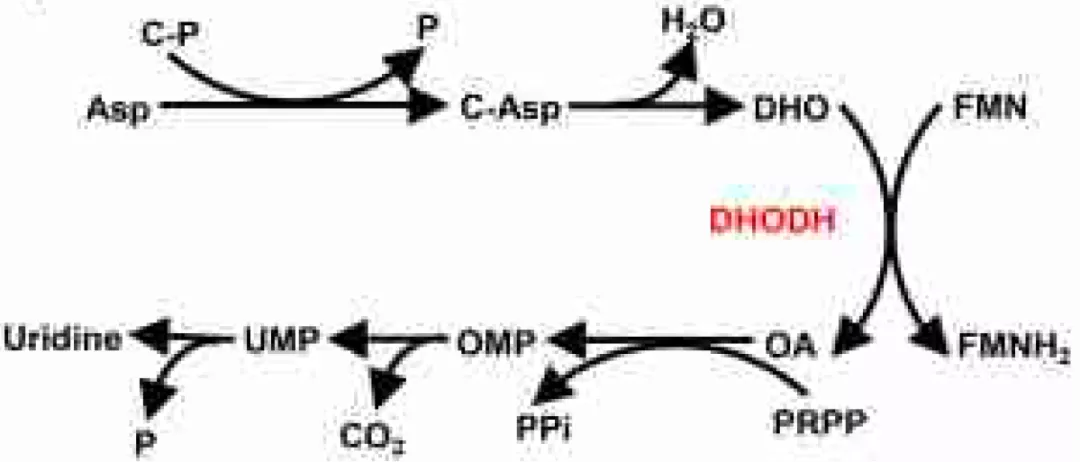
作者首先通过代谢组学分析发现,GPX4 抑制剂(RSL3 或 ML162)处理癌细胞可导致氨甲酰天冬氨酸(C-Asp,嘧啶生物合成的中间体)的降低,并伴有尿苷(uridine,嘧啶生物合成的最终产物)的累积。
图片来源:Nature
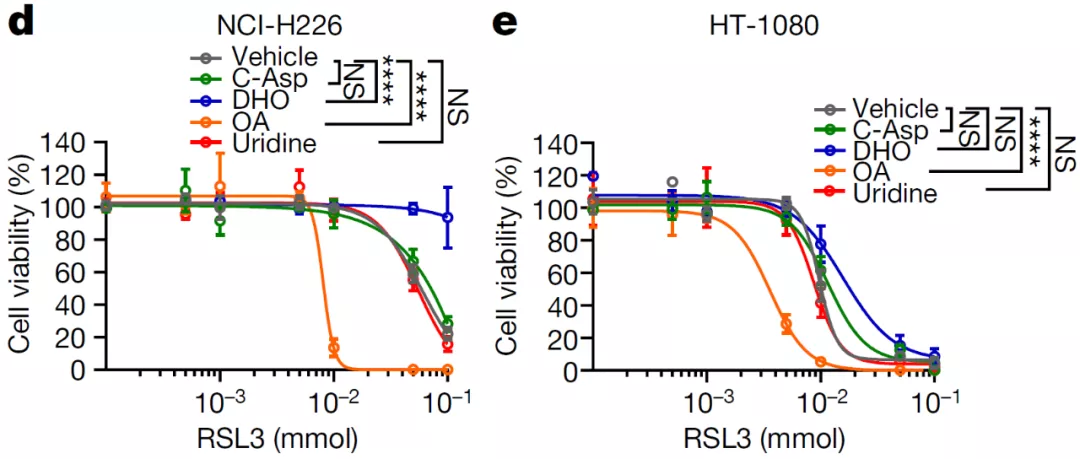
添加嘧啶生物合成中间体二氢乳清酸(DHO)对 GPX4 抑制剂造成的细胞死亡有保护作用,而乳清酸(OA)使细胞对 GPX4 抑制剂更加敏感;然而,添加尿苷并不影响细胞对 GPX4 抑制剂的敏感性。
图片来源:Nature
DHO 和 OA 分别是 DHODH 反应的底物和产物,DHO 和 OA 对铁死亡有着相反的影响,提示 DHODH 可能对于铁死亡有着调节作用。
作者发现抑制 DHODH 可诱导 GPX4 低表达的细胞(如 NCI-H226)发生铁死亡;对于 GPX4 高表达的细胞(如 HT-1080),抑制 DHODH 不能显著诱导铁死亡的发生,但能使细胞对铁死亡诱导剂变得更加敏感,而敲除 GPX4 可使 DHODH 抑制剂诱导脂质过氧化和铁死亡的发生。

图片来源:Nature
机制探究:DHODH 是如何抑制铁死亡的?
DHODH 是一种位于线粒体内膜外表面的酶。在 DHODH 敲除的 HT-1080 细胞中回转(restoration)野生型 DHODH,可降低 GPX4 抑制引起的铁死亡,然而回转 DHODH 催化活性突变体或线粒体定位缺陷突变体则没有这一作用。
此外,在敲除 HT-1080 细胞的 GPX4 后,回转线粒体定位的 GPX4(GPX4mito)可降低 DHODH 抑制引起的铁死亡,但回转胞质 GPX4(GPX4cyto)则没有这一作用。此外,在 HT-1080 细胞中抑制 GPX4 时并不会观察到显著的线粒体脂质过氧化,然而,GPX4 抑制剂在 DHODH 敲除的 HT-1080 细胞中可显著诱导线粒体脂质过氧化的发生。
这些结果提示 DHODH 抑制了线粒体铁死亡的发生。
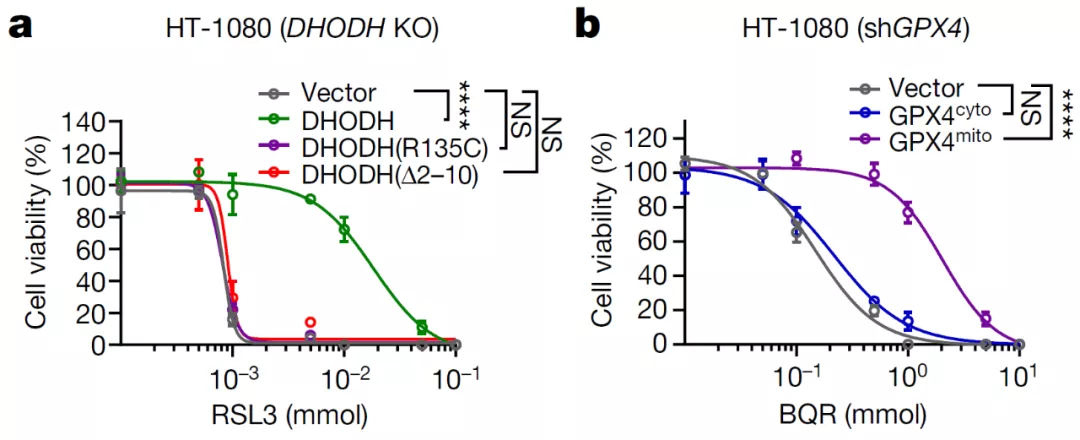
图片来源:Nature
DHODH 将线粒体内膜中 DHO 氧化为 OA 的同时将 CoQ 还原为 CoQH2。抑制 DHODH 增加了 CoQ/CoQH2 的比值。在 HT-1080 细胞中,补充 mitoQ 和 mitoQH2(分别是 CoQ 和 CoQH2 的线粒体靶向类似物)对 GPX4 抑制剂诱导的铁死亡提供有限的保护。然而在 DHODH 敲除的细胞中,mitoQH2(而不是 mitoQ)可显著消除 GPX4 抑制剂诱导的线粒体脂质过氧化和铁死亡。

图片来源:BBA - Molecular Basis of Disease (3)
这些结果表明 DHODH 可通过将 mitoQ 还原为 mitoQH2 来抑制铁死亡的发生。
临床应用:DHODH 抑制剂促进肿瘤铁死亡
作者进一步研究了 DHODH 抑制剂在肿瘤治疗中的应用潜力。
Brequinar 是一种已经在多个临床试验中测试过的 DHODH 抑制剂。作者发现,尽管单用 brequinar 治疗或敲除 GPX4 不影响小鼠 HT-1080 移植瘤的生长,但敲除 GPX4 使 HT-1080 移植瘤对 DHODH 抑制变得敏感。而铁死亡抑制剂 liproxstatin-1 处理可以消除 brequinar 对 GPX4 敲除肿瘤的抑制作用。

图片来源:Nature
类似地,brequinar 抑制 NCI-H226(GPX4 低表达)或 GPX4 低表达患者来源的异种移植瘤(PDXs)的生长,但不抑制 GPX4 高表达的 PDXs。
最后,作者在 GPX4 高表达的移植瘤中发现,brequinar 与柳氮磺胺吡啶(抑制 SLC7A11 的铁死亡诱导剂)联合治疗可协同诱导脂质过氧化并抑制肿瘤生长,而 liproxstatin-1 可以消除这一抑制作用。
因此,DHODH 抑制剂具有治疗 GPX4 低表达癌症的潜力,而 DHODH 抑制剂与柳氮磺胺吡啶联合用药具有治疗 GPX4 高表达癌症的潜力。
研究总结
本研究在现有的两大铁死亡保护系统的基础上提出了第三大保护系统,这三大系统具有独特的亚细胞定位:细胞质和线粒体上的 GPX4、质膜上的 FSP1 和线粒体上的 DHODH。
DHODH 和线粒体 GPX4 是消除线粒体脂质过氧化物的两个主要防御系统,丧失其中一个系统会迫使细胞更加依赖另一个,而同时丧失这两个保护系统会引发主要由线粒体脂质过氧化诱导的铁死亡。
最后,考虑到 DHODH 抑制剂和柳氮磺胺吡啶已经被 FDA 批准或在临床中广泛测试,将 DHODH 抑制剂作为铁死亡的诱导剂可能对癌症治疗有着直接的转化意义。
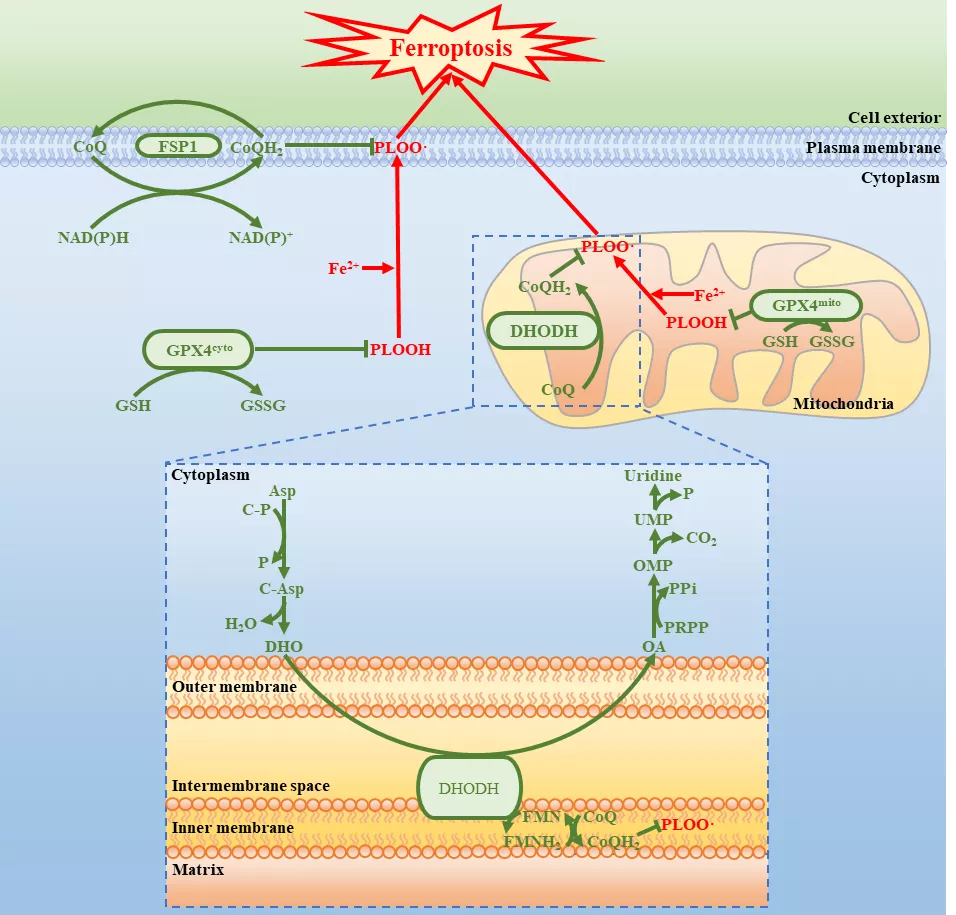
图片来源:Nature
延伸阅读
甘波谊教授团队的研究兴趣主要集中在了解正常细胞和癌细胞中的营养信号和代谢应激反应。
课题组近年的研究主要集中在两个方向上:
1)铁死亡在细胞代谢、肿瘤抑制和癌症治疗中的作用和机制:
团队最近的研究发现铁死亡是一种重要的肿瘤抑制机制,并揭示了铁死亡在放射治疗诱导的细胞死亡和肿瘤抑制中的关键作用。(Zhang et al, Nature Cell Biology, 2018(4);Lei et al, Cell Research, 2020(5);Zhang et al, Nature Communications, 2021(6);Lee et al, Nature Cell Biology, 2020(7))
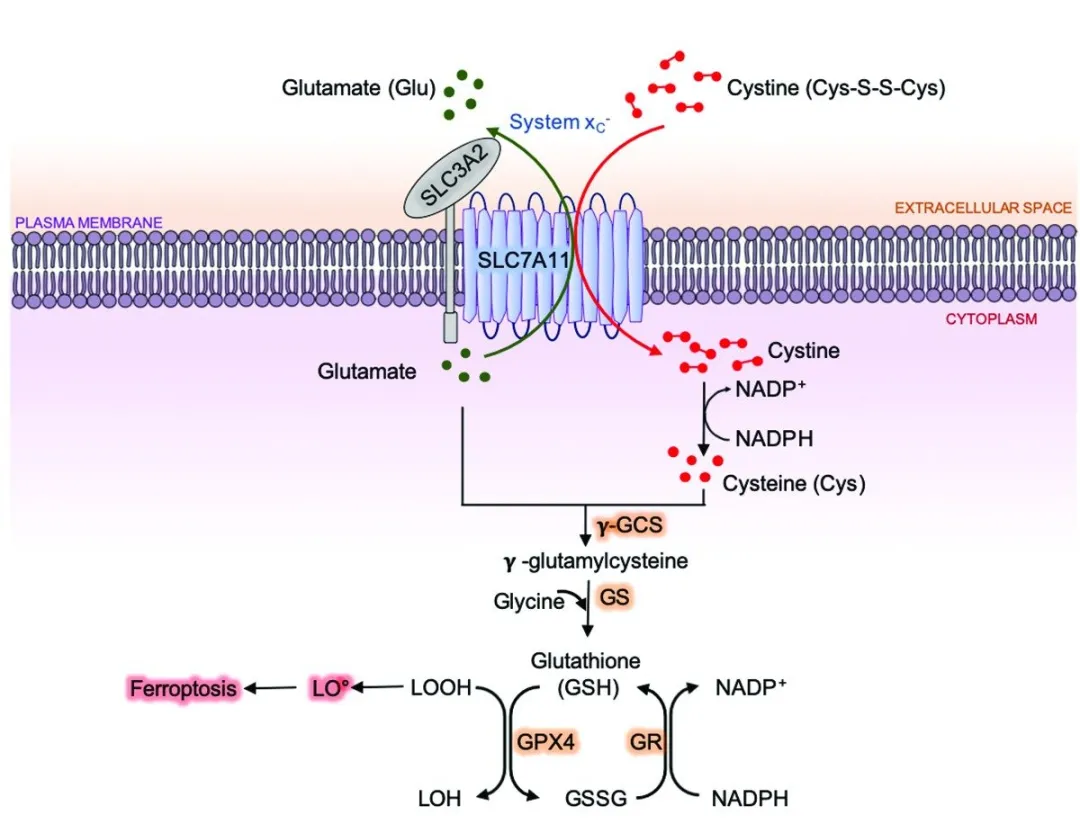
图片来源:Research - Gan Lab | MD Anderson Cancer Center
2)胱氨酸代谢诱导的营养依赖性及其在癌症治疗中的意义:
团队最近的研究发现,在 SLC7A11 高表达的癌细胞中,SLC7A11 相关的胱氨酸代谢在葡萄糖受限的条件下诱导二硫化物累积和细胞快速死亡,并提出了针对 SLC7A11 高表达的癌细胞代谢弱点的治疗策略。(Liu et al, Nature Cell Biology, 2020(8);Zhang et al, Cancer Research, 2020(9))
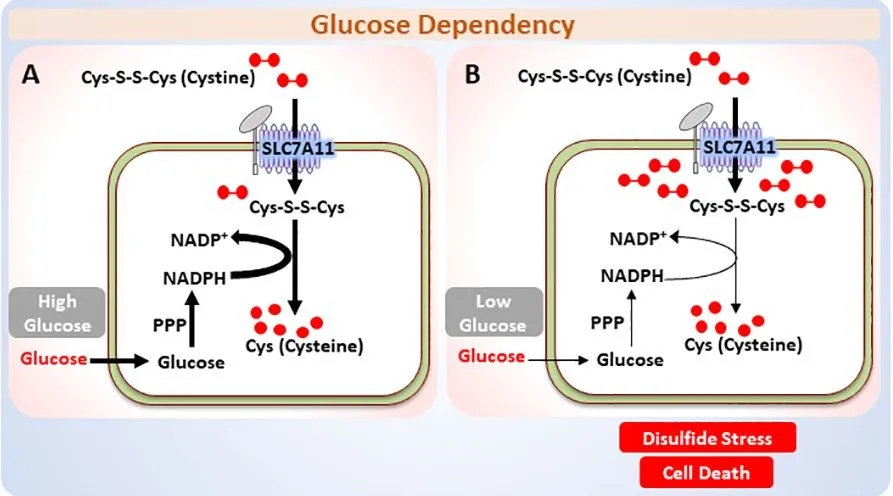
图片来源:Research - Gan Lab | MD Anderson Cancer Center
题图来源:站酷海洛 Plus