Nature:清华柴继杰 / 南农王源超团队首次揭示植物免疫受体蛋白的双功能抗病机制
丁香学术
在与病原菌的长期斗争中,植物进化出精细、复杂的多层免疫系统保护自身免受侵害。定位于细胞膜表面的植物模式识别受体(Pattern Recognition Receptors,PRRs)作为监控病原菌侵害的「前哨」,通过识别病原菌的病原相关分子模式,激活对多种病原菌的广谱抗性。
PRR 主要是由受体激酶(Receptor Kinases, RKs)和受体蛋白(Receptor-Like Proteins, RLPs)组成。其中重要的一类 PRR 胞外配体识别结构域由富含亮氨酸的重复基序(LRR)构成,因此被称为 LRR 型 PRR,其可进一步分为 LRR- RKs 和 LRR- RLPs。
尽管目前我们对受体激酶(LRR-RKs)的配体识别及活化的分子机制有了较为深刻的理解,但是对于参与植物抗病的另一大类 LRR-RLPs 的配体识别及活化分子机制一直不清楚。
2022 年 9 月 21 日,清华大学柴继杰教授团队和南京农业大学王源超教授团队合作在国际权威学术期刊《自然》(Nature)杂志上发表论文,通过解析受体 RXEG1 单独(apo-RXEG1)、受体-配体识别(RXEG1-XEG1)和受体-配体-共受体复合物(RXEG1-XEG1-BAK1)等多种不同状态的结构,结合生物化学和植物细胞生物学等手段进一步阐明了其发挥功能的具体机制。
这项研究阐明了细胞膜受体蛋白 RXEG1 识别病原菌核心致病因子 XEG1,从而激活植物免疫的作用机制,首次揭示了细胞膜受体蛋白具有激活免疫活性和直接抑制致病因子 XEG1 酶活的双重免疫功能,对认识、合理利用和精准改造植物免疫受体,提高作物广谱抗性具有重要的指导意义。
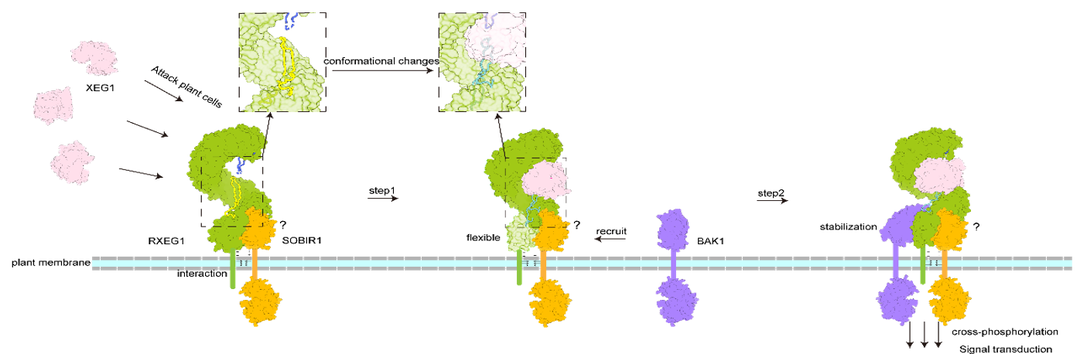
图 1:RXEG1 受体识别致病因子 XEG1 活化免疫的示意图
研究发现 RXEG1 主要通过胞外 N 端帽子和 C 端岛区形成的两个独特的 loop 结合 XEG1。通过对 RXEG1 单独冷冻电镜结构和受体-配体识别(RXEG1-XEG1)晶体结构的比较,发现 XEG1 的结合引起了 RXEG1 岛区及 C 末端的构像发生明显的变化,这种改变诱导共受体 BAK1 的结合并进一步稳定 RXEG1 岛区和 C 端 4 个 LRR 基序的构象变化。
受体-配体-共受体活化复合物(RXEG1-XEG1-BAK1)结构显示,XEG1 并不直接参与 RXEG1 与共受体 BAK1 的互作,而是通过别构效应间接促进 RXEG1 与 BAK1 的异源二聚化。体内生化和功能分析也明确了 XEG1 诱导 RXEG1 岛区构象改变进而诱导 BAK1 结合形成异源二聚体来激活下游免疫信号通路的分子机制。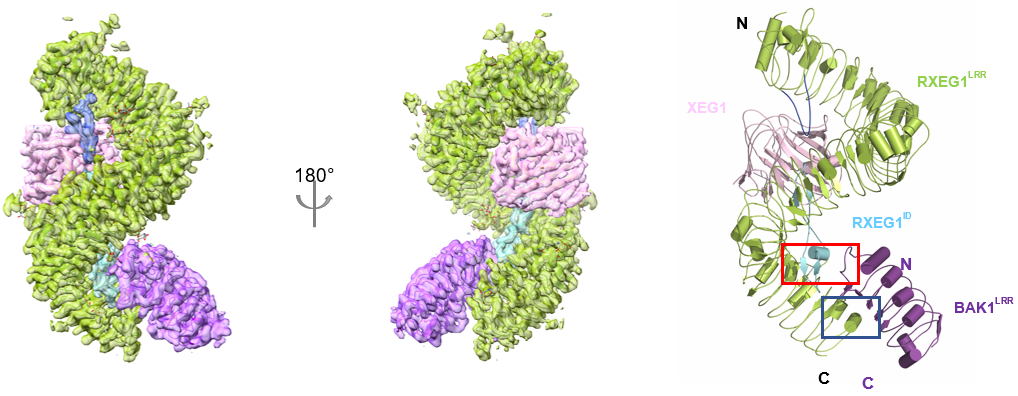
图 2:RXEG1-XEG1-BAK1 复合体结构
有趣的是,该研究发现受体 RXEG1 的两个 loop 区恰好结合在 XEG1 的酶活性位点的口袋中。王源超教授实验室先前研究已经揭示 XEG1 的酶活性对于病原菌的致病性是必需的。该研究通过体外酶活抑制实验及植物体内实验证明了破坏 RXEG1 免疫识别受体功能后,RXEG1 依然能够发挥对 XEG1 水解酶抑制作用来抑制病原菌的侵染。这些现象表明受体 RXEG1 通过抑制致病因子 XEG1 的糖基水解酶活性来直接发挥抗病功能。
综上所述,该研究首次揭示了植物免疫受体蛋白的配体识别及激活的分子机制,并发现了植物受体蛋白在免疫过程中的双重功能,为理解植物受体蛋白家族的功能及结构研究提供了范式。