Nature:施一 / 高福团队揭示埃博拉病毒聚合酶工作的分子机制
丁香学术
埃博拉病毒病是由埃博拉病毒引起的烈性急性传染病,主要在人或灵长目动物之间传播。自 1976 年首次在非洲扎伊尔和苏丹被发现后,埃博拉病毒已在非洲肆虐了近 50 年,暴发过 30 多次,造成数万人死亡,病死率最高可达 90%。其中,2014-2016 年暴发于西非国家的埃博拉疫情,是有史以来最严重的一次,共导致约 2.9 万人感染,1.1 万多人死亡。2021 年在西非国家几内亚再次发现埃博拉病毒活跃迹象,提示病毒可能存在潜伏感染。此外,2018-2020 年暴发于刚果民主共和国的埃博拉疫情也导致 3481 人感染,2299 人死亡。今年 9 月,非洲乌干达又再次出现新的埃博拉疫情。这些数据告诉我们,埃博拉疫情并没有完全结束,并时刻威胁着我们的生命健康,因此急需加强针对埃博拉病毒的科学研究。
埃博拉病毒属于丝状病毒科,基因组为不分节段的负链 RNA,长约 19 kb,包含 7 个阅读框。病毒 RNA 基因组被核蛋白(NP)包裹,进一步与聚合酶蛋白(L),病毒辅助蛋白(VP35)和转录激活蛋白(VP30)结合形成核糖核蛋白复合体(RNP)。在病毒粒子中 RNP 进一步与核衣壳相关蛋白(VP24)结合,并被基质蛋白(VP40)环绕,进一步与病毒表面刺突糖蛋白(GP)形成完整病毒颗粒。病毒表面 GP 蛋白在细胞入侵和免疫逃逸方面发挥着重要作用。目前已上市的两款针对扎伊尔型埃博拉病毒的抗体药物,其作用靶点就是埃博拉病毒表面 GP 蛋白。但是抗体药物在制造成本、存储和使用便利性上面具有局限性,而且病毒 GP 蛋白在宿主免疫压力下容易发生免疫逃逸,造成抗体药物效果变差甚至无效。此外由于抗体药物的特异性,无法用于治疗其他类型埃博拉病毒以及马尔堡病毒等丝状病毒。因此,开发有效安全的广谱性抗病毒小分子药物是未来应对不同类型埃博拉病毒和其他丝状病毒感染的重要研究方向。
埃博拉病毒基因组的转录与复制过程由病毒聚合酶 L 蛋白和其他辅助蛋白形成的复合物来共同完成。由于聚合酶复合物在不同的丝状病毒中具有高度保守性,是非常理想的广谱性抗病毒药物开发靶点。前期研究发现法匹拉韦和瑞德西韦等核苷类似物具有良好的体外抗病毒活性,但是临床效果并不理想,目前临床上还没有批准可用于治疗埃博拉病毒感染的小分子药物。现有的靶向聚合酶药物如何进行结构优化,以及能否针对聚合酶保守位点开发新的药物来治疗埃博拉病毒病?要想回答这些问题,那就迫切要求研究人员弄清楚埃博拉病毒的复制机制,阐明其聚合酶发挥功能的分子基础。但是,由于埃博拉病毒聚合酶的分子量大、不稳定、易降解等因素,其三维结构的解析一直是世界性难题,从而严重限制了靶向聚合酶的药物开发。
2022 年 9 月 28 日,中国科学院微生物研究所研究人员施一和高福院士在 Nature 上发表了题为 Structure of the Ebola virus polymerase complex 的文章,经过多年的尝试摸索,研究人员成功表达纯化获得了埃博拉病毒聚合酶复合物蛋白(L-VP35 复合物),并利用冷冻电镜技术解析其高分辨率三维结构(图 1)。

图 1:埃博拉病毒 L-VP35 聚合酶复合物整体结构
通过结构分析,研究人员发现埃博拉病毒的聚合酶 L 蛋白与 VP35 蛋白四聚体形成稳定的复合物,其聚合酶活性结构域和加帽结构域与呼吸道合胞病毒(RSV)和狂犬病毒(RABV)等其它不分节段负链 RNA 病毒聚合酶结构相似,说明不分节段的负链 RNA 病毒聚合酶在进化过程中具有保守性。值得注意的是,埃博拉病毒聚合酶的 N 端结构域具有一个丝状病毒特有的插入结构域,并在埃博拉病毒聚合酶发挥活性时是必不可少的,可成为潜在的抗病毒药物研发靶点。
病毒聚合酶在生成子代 RNA 的过程中涉及到多种构象变化,从而促进产物顺利合成,其中最重要的构象变化是从起始态到延伸态的转变。前期研究提示,聚合酶从起始状态进入到延伸状态时,酶活中心的两个关键结构元件,priming loop 和 supporting helix 必须发生巨大的构象调整才能保证产物链有足够的空间进行延伸,否则它们就会与产物链发生空间位阻(图 2a)。我们通过改变冷冻电镜的制样条件,捕捉到了埃博拉病毒聚合酶处于延伸状态时的精细结构。通过结构比对分析发现,在处于延伸构象时,priming loop 完全缩回到加帽结构域,而 supporting helix 也会远离聚合酶的活性中心,从而为模板/产物双链 RNA 提供足够的空间进行延伸(图 2b)。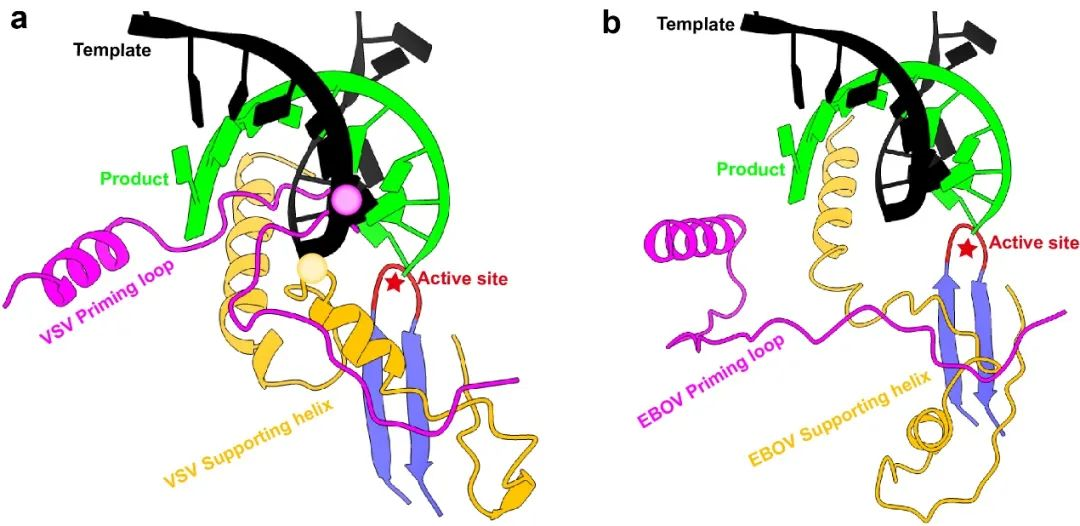
图 2:处于起始和延伸状态时的聚合酶活性中心构象
病毒 VP35 蛋白具有连接 L 蛋白和病毒 RNP 的功能,是聚合酶 L 蛋白发挥活性不可或缺的伴侣蛋白,同时还能结合单体状态下的病毒 NP 蛋白,阻止其与宿主 RNA 发生非特异性相互作用,保证单体 NP 蛋白能够用于子代 RNP 的生成。之前有研究报道,埃博拉病毒的 VP35 蛋白能以三聚体或四聚体的形式存在,但是以何种形式与聚合酶 L 蛋白形成复合物来介导病毒基因组复制和转录的机制尚不清楚。本文首次揭示病毒 VP35 以四聚体形式与聚合酶 L 蛋白进行结合。其中只有 3 个 VP35 蛋白与 L 蛋白发生直接相互作用,结合区域涉及 L 蛋白的手指结构域,手掌结构域和 N 端结构域,以氢键和疏水相互作用为主。L-VP35 相互作用界面的分子细节为进一步开发靶向聚合酶的药物提供了新的靶点以及重要指导信息。
开发能有效抑制埃博拉病毒的小分子药物一直是国际热点和难点。前期研究提示百年老药苏拉明具有良好的体外抗埃博拉病毒活性,但是其确切的分子机制尚不清楚。研究人员通过体外酶活和细胞复制子实验发现苏拉明能有效地抑制埃博拉病毒聚合酶活性,并进一步利用冷冻电镜技术解析了埃博拉病毒聚合酶与苏拉明的复合物结构,揭示苏拉明是通过结合在聚合酶的 NTP 进入通道,阻碍底物进入酶活中心而发挥抑制作用。苏拉明药物与 L 蛋白相互作用的分子细节,为进一步改造和优化苏拉明药物提供了关键参考信息。
综述所述,该研究首次解析了埃博拉病毒聚合酶的结构,阐明了其合成子代 RNA 的分子机制,明确了不分节段负链 RNA 病毒在进行转录和复制时,从起始状态向延伸状态转变时的动态变化,为从分子水平理解埃博拉病毒复制机制奠定了关键理论基础;同时,该工作发现苏拉明药物能通过抑制 NTP 底物进入酶活中心而有效抑制埃博拉病毒聚合酶的活性,不仅为防控埃博拉疫情提供了候选治疗方案,也为抗埃博拉病毒的药物开发提供了新的靶点和方向。