Mol Cell:高福/尚桂军等团队合作揭示STING自抑制和内质网滞留的结构基础
丁香学术
导读
胞质中双链 DNA(dsDNA)能够被免疫系统识别,其主要传感器之一是环 GMP-AMP 合成酶(cGAS),它以 ATP 和 GTP 为底物合成 3', 2'-cGAMP。cGAMPs 作为第二信使激活干扰素基因刺激因子(STING),而作为一种内质网驻留蛋白,STING 在 cGAMP 刺激后由内质网向高尔基体转运,这被认为是信号转导的关键步骤。
活化的 STING 利用其 C 端尾部募集并激活 TANK-binding kinase 1(TBK1)和转录因子干扰素调节因子 3(IRF3),诱导干扰素(IFN)刺激基因的转录,最终达到抗感染免疫应答。然而,STING 的异常激活与自身免疫性和自身炎症性疾病有关。因此,揭示 STING 的工作机制对于开发抗感染、抗肿瘤以及自身免疫性疾病的疗法具有重要意义。
近年来,虽然有研究报道了几例起病于婴儿期的 STING 相关血管病变(SAVI)患者伴有组成性 STING 激活,但这些 SAVI 患者的功能获得突变机制尚未得到解决。此外,STING 的 CTT 也被认为是结合自身的自抑制元件。然而,先前的结构研究从未捕获到尾端与 STING 其他部分结合的构象,这使人们对其在 STING 自抑制中的作用产生了怀疑。因此,如何抑制 STING 及其内质网滞留机制仍有待解决。
2023 年 4 月 21 日,山西高等创新研究院尚桂军团队、中科院微生物所高福团队、山西农业大学卢德芬团队以及南方科技大学王培毅团队合作在 Molecular Cell 发表了题为 The mechanism of STING autoinhibition and activation 的文章,在这项研究中,他们使用冷冻电镜测定了 apo 形式和 cGAMP 结合形式的 STING 结构,并观察到载脂蛋白 STING 的自关联,这为理解 STING 的自抑制和内质网滞留提供了结构基础。此外,他们还可视化了 cGAMP 结合的 STING 聚合物,这为其内质网出芽和转运提供了结构学解释。
总之,该研究提供了一个关于 STING 自抑制和激活的全景视图,大大增加了对 cGAS-STING 途径的理解。
主要研究内容
载脂蛋白 STING 以低聚物形式存在
先前的研究已经确定 STIM1 是一个结合伴侣,支持 STING 的内质网滞留,不过一直缺乏令人信服的直接证据。通过实验,研究人员发现,在没有 cGAMP 处理的情况下,所有被测物种的 STING 都可以形成高阶低聚物。他们还观察到内源性载脂蛋白 STING 聚合物的存在,并且 cGAMP 的处理还增加了这些高阶低聚物的水平。
然后,他们通过受激发射损耗(STED)超分辨率显微镜和免疫胶体金电子显微镜确定内源性 STING 蛋白的亚细胞定位。与内质网标记物相比,在 STED 显微镜下检测到的 PAM 细胞内源性 STING 在内质网膜上没有弥漫性分布;相反,它似乎定位于内质网的一个亚结构域,通常连接两个内质网小管。这表明载脂蛋白 STING 可以形成低聚物,并且在静息状态下连接两个内质网膜。
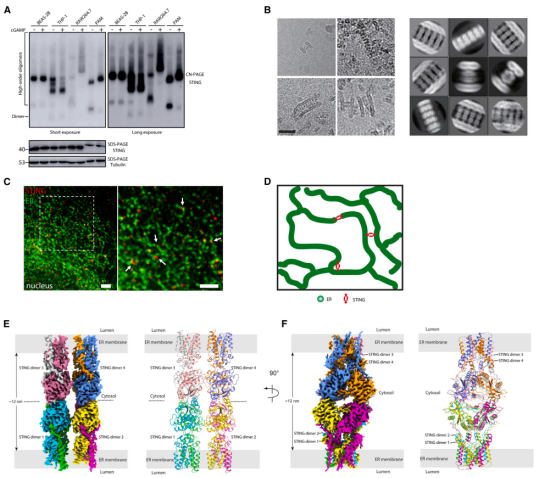
图片来源:Molecular Cell
载脂蛋白 STING 的 LBDa2-loop-LBD-a3 在维持 STING 双分子层中起着至关重要的作用
为了了解载脂蛋白 STING 低聚物的详细组装机制,研究人员使用冷冻电镜(cryo-EM)在原子分辨率上确定其结构。发现载脂蛋白 STING 低聚物的整体结构呈现出与双层 STING 的线性组合。在每一层中,STING 二聚体通过并排包装与相邻的 STING 二聚体相互作用。从俯视图看,STING 二聚体和聚合物轴形成一个倾斜的交叉点。
进一步的研究发现,载脂蛋白 STING 低聚物的并排堆积主要由 LBDa2 和 LBDa3 螺旋之间的环介导。残基 D280 与邻近 STING 分子 LBDa3 中的残基 R286 和 R289 形成盐桥。两个相邻的 STING 分子之间的这种对称相互作用使 STING 聚合物从侧面相互连接。
为了测试这些残基在该界面中的功能重要性,他们测试了这些残基的诱变是否能够以不依赖于 cGAMP 的方式激活 STING。结果发现,与野生型 STING 相比,Q273E 突变体具有更高的 STING 通路基础磷酸化水平,更高的 IFN-β 报告基因活性,即使没有 cGAMP 刺激,也增加了 STING 聚集体的形成。
此外,他们还突变了 LBDa2-loop-LBD-a3 上的其他残基,如 Q276 和 G278,并研究了它们对 hSTING 自抑制的影响,发现 Q276K 突变体可能与邻近 STING 原聚体的 R281 产生电荷排斥,而 G278R 可能由于 R 侧链粗大而破坏界面。这两种突变均导致 STING 以不依赖 cGAMP 的方式激活,因此,LBDa2-loop-LBD-a3 在维持 STING 自抑制中起到重要作用。
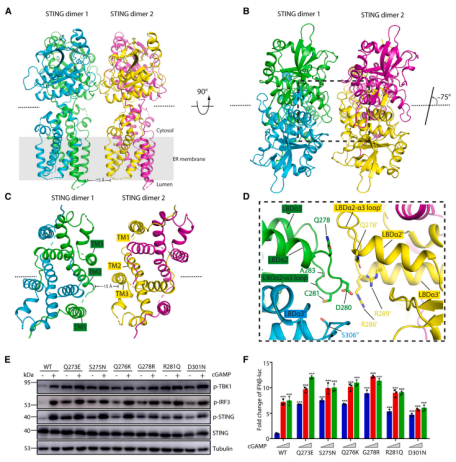
图片来源:Molecular Cell
hSTING/cGAMP 的结构揭示了 LBD 和 TMD 的相互作用
通过晶体堆积分析和低温电镜研究,多个团队均发现 STING 配体通过并排堆积模式形成聚合物,但 cGAMP/STING 聚合物如何组装仍然不清楚。
通过 hSTING,该团队得到了一个聚合的 STING/cGAMP 复合物,并通过低温电镜对其结构进行了解析。从侧面看,整体结构呈曲线状;从俯视图看,STING 二聚体和聚合物轴形成垂直相交。相邻 STING 原体之间的相互作用不仅发生在胞质配体结合结构域(LBD)上,也存在于跨膜结构域(TMD)之间。
图片来源:Molecular Cell
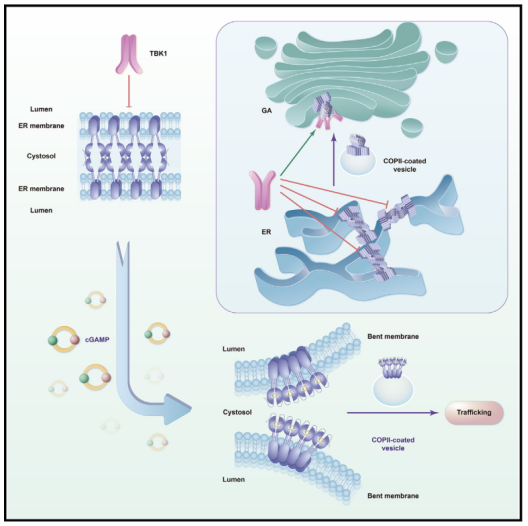
STING 具有自抑制和活化作用
STING 的静息状态是由 LBD 通过顺式和反式的头对头和并排包装相互作用来维持的,而 STING 的活性状态是由 LBD 和 TMD 在顺式中的相互作用来稳定的。尽管 STING 的活性和非活性状态都采用封闭的构象,不过这两个盖子的构象是不同的。对于这两种状态,顺式相互作用都涉及到 LBDa2-loop-LBD-a3,但这两种状态下 LBDa2-loop-LBD-a3 的构象也不同。
将载脂 STING 的结构叠加到活性 hSTING 聚合物上,两个相邻的载脂 STING 二聚体在 LBDa2-loop-LBD-a3 区域发生严重冲突,表明 cGAMP 结合后 LBD 结构域收缩,减轻了对 TMD 的抑制作用。除了 LBD 在配体结合后发生重排外,TMD 和连接螺旋也发生构象变化。在静息状态下,TM3 与相邻的 STING 二聚体中的另一个 TM3 接近,而远离 TM1-TM2;然而,在活动状态下,每个 TM3 直接与相邻的 STING 二聚体的 TM1-TM2 接触。由于 LBD 二聚体在配体结合后向内运动,连接器螺旋出现挤压和扭曲向下倾斜的现象,这导致 TM2 和 TM3 之间的螺旋连接体向内运动,产生向外推动 TM2 和 TM3 的力。
考虑到 STING 通过头对头的模式参与 TBK1,载脂 STING 的头对头组装表明它可以阻止 TBK1 的募集并抑制信号转导。因此,载脂蛋白 STING 聚合物结构代表了 STING 的自抑制状态,并且 LBD 在维持其自抑制中起着重要作用。配体与 LBD 结合,则可通过破坏载脂蛋白 STING 聚合物内的顺式和反式相互作用,引起 LBD 和 TMD 的重排。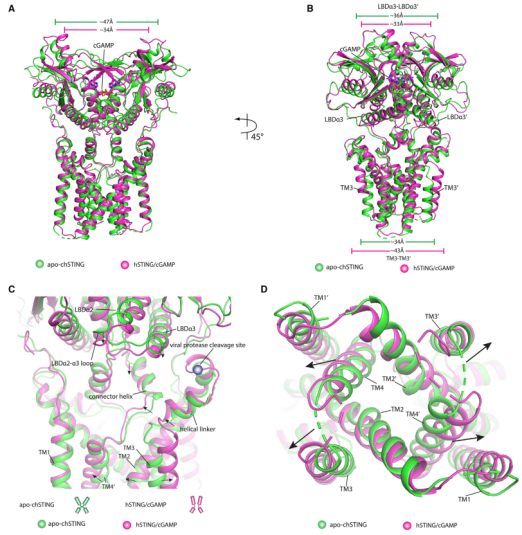
图片来源:Molecular Cell
结语
综上所述,在这项研究中,他们发现载脂蛋白 STING 可以组装成高阶低聚物。载脂蛋白 STING 表现出一个由其配体结合域(LBD)介导的头对头和并排包装的双层结构,这种结构将两个内质网膜结合在一起,不仅可以保持 STING 内质网滞留,还可以实现 STING 的自抑制。此外,他们还获得了 STING/cGAMP 复合物的丝状结构,该复合物采用 LBD 和跨膜结构域 (TMD) 介导的弯曲单层组装。
自抑制和活性 STING 的结构解析为了解 STING 的生理和病理作用提供了大量信息,并为合理设计药物以可控地调节 STING 活性提供了可能。
图片来源:Molecular Cell
题图来源:站酷海洛
参考文献:
1. Liu et al., (2023). The mechanism of STING autoinhibition and activation, Molecular Cell.
2. Hussain, B., et al., (2022). Activation of STING based on its structural features. Front. Immunol.
3. Ahn, J., and Barber, G.N. (2019). STING signaling and host defense against microbial infection. Exp. Mol. Med.