Nature 背靠背 | 浙大周青/John Silke 团队揭示关键蛋白激酶调控自体免疫疾病的分子机制
自体免疫疾病(autoimmune disease)是一类由免疫系统的异常激活引起的疾病。
在这种情况下,过度激活的免疫细胞丧失了辨别「自己」与「非己」的能力,从而对自身组织器官展开攻击,并引起发烧和炎症反应。严重情况下,自身免疫反应会对身体重要器官造成不可逆的影响。
针对介导自体免疫疾病发生的分子机制,科学家们长期以来在不断努力探索。
近日,Nature 杂志在线刊登了两篇重磅级文章,同时揭示了关键蛋白激酶 RIPK1 的突变以及酶活性的改变对炎症反应以及自体免疫疾病发生的影响。
文章作者分别是来自浙江大学生命科学研究院的周青博士团队以及来自澳大利亚 The Walter and Eliza Hall Institute 的 John Silke 博士团队。
背景介绍
此前研究已经表明,RIPK1 是调节细胞凋亡、坏死以及炎症反应的关键元件。在受到 TNFR1 激活的信号之后,RIPK1 的随之激活会引发细胞凋亡(apoptosis)以及细胞坏死性凋亡(necroptosis)1。
另一方面,RIPK1 的活性还受到了「细胞凋亡关键激酶」—— Caspase 8 的调控。
在自然条件下,Caspase 8 能够切割 RIPK1,导致后者 N 端的激酶结构域与中部以及 C - 端的死亡结构域分离,进而抑制 RIPK1 的激活(死亡结构域负责 RIPK1 的二聚化,对于 RIPK1 的活性具有必需的作用)。
在人类细胞以及小鼠模型中,Asp 的突变(D-A)会阻断 Caspase 8 的正常切割以及 RIPK1 的异常活化,进而大幅提升细胞对凋亡以及坏死信号的敏感性。
在小鼠中,RIPK1 的上述突变会导致胚胎死亡事件的发生。

图片来源:作者自制
后续的一些研究中,研究者们发现:对于 RIPK1(D324A)纯合小鼠胚胎致死的情况,如果同时敲除 FADD 蛋白(参与外源性细胞凋亡)与 RIPK3 蛋白(参与细胞坏死性凋亡)2,或者同时敲除 FADD 蛋白与 MLKL 蛋白(参与细胞坏死性)3,均能够挽救小鼠的生命。
然而,其中的分子机制却仍没有得到清晰地揭示;此外,正常情况下 Caspase 8 对 RIPK1 的切割究竟有何生理意义仍不得而知。
主要内容

图片来源:Nature
对于周青博士团队而言,一名 2 岁左右的男性儿童患者(P1)是整个研究的起点 4。
这名儿童患者由复旦大学附属儿童医院王晓川博士接收,主要症状为反复发烧:始于两月龄,每八到十天发生一次,每次持续三到五天;此外还伴随着淋巴结肿大,相关血液炎症指标上升(C-reactive protein,白细胞计数等)等。
然而,该患儿并没有其他相关症状或者感染的发生。
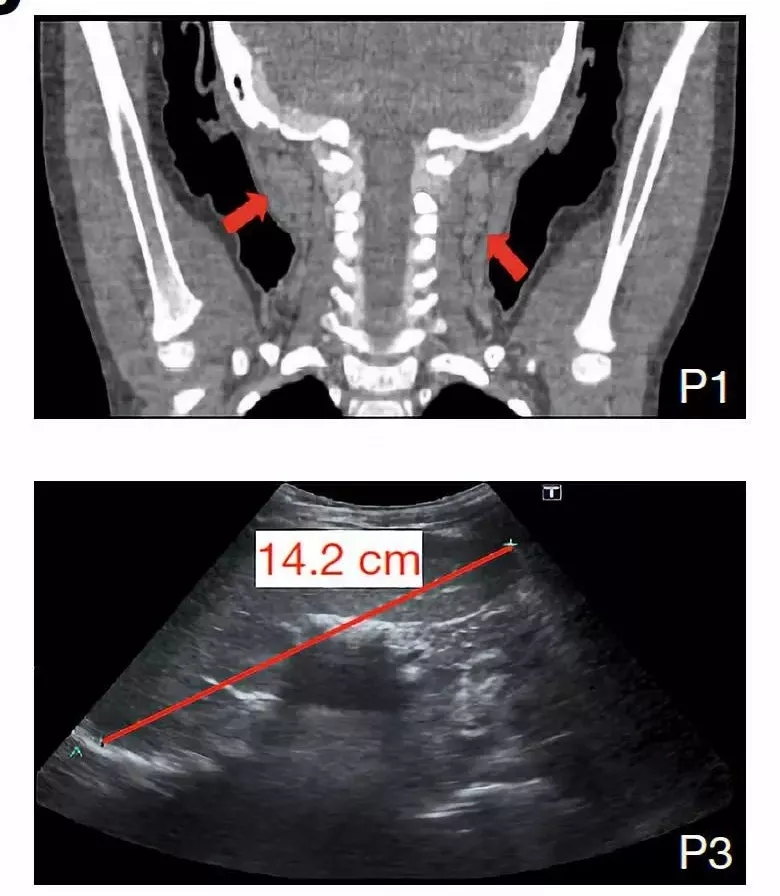
CT 扫描(上)与超声(下)分别显示淋巴结与脾脏肿大
图片来源:Nature
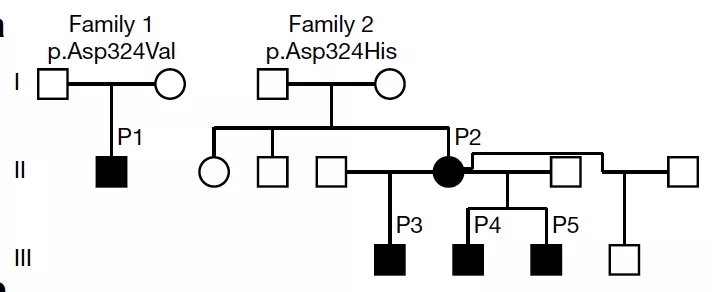
无独有偶,作者们得知,一位 35 岁的欧裔女性(P2)也出现类似的「反复发烧」的症状,最早从 6 个月大开始,也伴随着间歇性淋巴结肿大、脾肿大以及小细胞性贫血症状。
此外,她的四个孩子中的三个也出现了类似的症状。(由于该女性患者有多次婚姻,患病的三个孩子并非同一个父亲)。由此,作者深度怀疑这是一类先天遗传性疾病。
通过对该患儿(P1)以及其父母进行外显子测序,作者发现:该患儿的 RIPK1 蛋白存在 D324V 杂合突变。
相似地,作者同时发现欧裔女性患者的 RIPK1 蛋白存在 D324H 杂合突变,并且很不幸地传递给了他的三个孩子。
由此,RIPK1 突变与症状的发生之间便建立了联系。
图片来源:Nature
通过实验室水平的检测,作者们验证了 RIPK1 的上述突变(D324V, D324H)能够产生与之前研究发现的 D324A 相同的效果:Caspase 8 对突变 RIPK1 蛋白的切割受到了抑制。
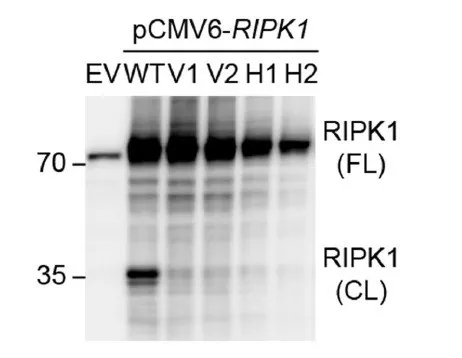
图片来源:Nature
进一步,作者比较了 P1 患儿与健康对照的外周血单核细胞中与炎症反应相关的信号激活以及炎性因子的产生情况。
结果表明,与对照相比,患者的细胞中与细胞死亡,NF-kB 以及 I 型干扰素相关的信号都出现了明显的上调。
此外,患者炎性因子(例如 TNFa,IL-6,IL-1b 等)的表达量都有明显升高。
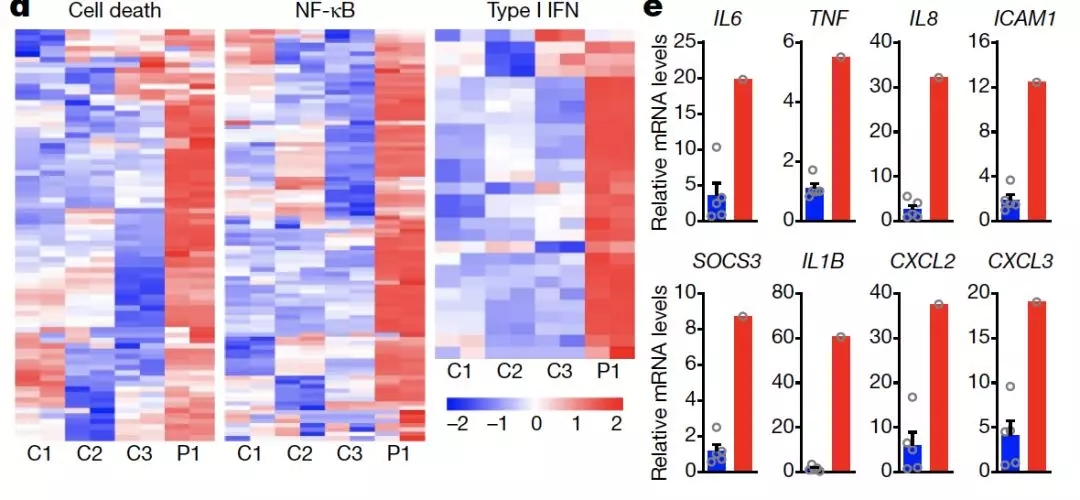
图片来源:Nature
之后,作者对患者以及健康供体来源的外周血单核细胞施加了外源的一系列刺激,用于引发细胞死亡与炎症反应。结果表明,相比健康供体来源的 PBMC,患者的细胞死亡程度与炎症反应程度明显加强。
此外,通过对野生型以及突变体的小鼠来源的 MEF 进行体外检测也证明了这一点。
由下图可以看出,相比健康供体(蓝色),患者来源的细胞响应 TNFa(T)以及 SM-164(S)后细胞死亡程度更加明显,这一效应不能被细胞凋亡抑制剂 z-VAD-FMK(Z)抑制,但能够被细胞坏死性凋亡抑制剂 Necrostatin(N)抑制,表明引发的是坏死性凋亡。
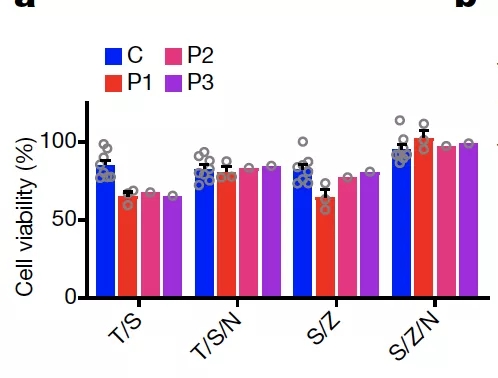
图片来源:Nature
另一边,来自澳大利亚的 John Silke 博士等人也发现了部分患者存在「高烧反复发作」以及淋巴结、脾脏肿大的症状。
同时,高通量测序结果表明这些患者也都存在 RIPK1 蛋白的错义突变(包括 D324N, D324Y, D324A)以及稳定的遗传特征。

图片来源:Nature
进一步,作者通过体外检测表明,上述突变均能够影响 caspase 8 对 RIPK1 的切割,从而导致 RIPK1 的异常活化。这也许就是患者出现严重炎症反应的原因。
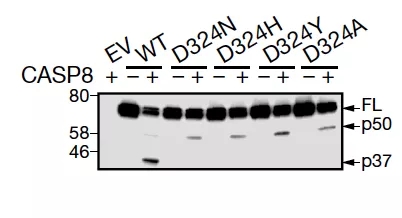
图片来源:Nature
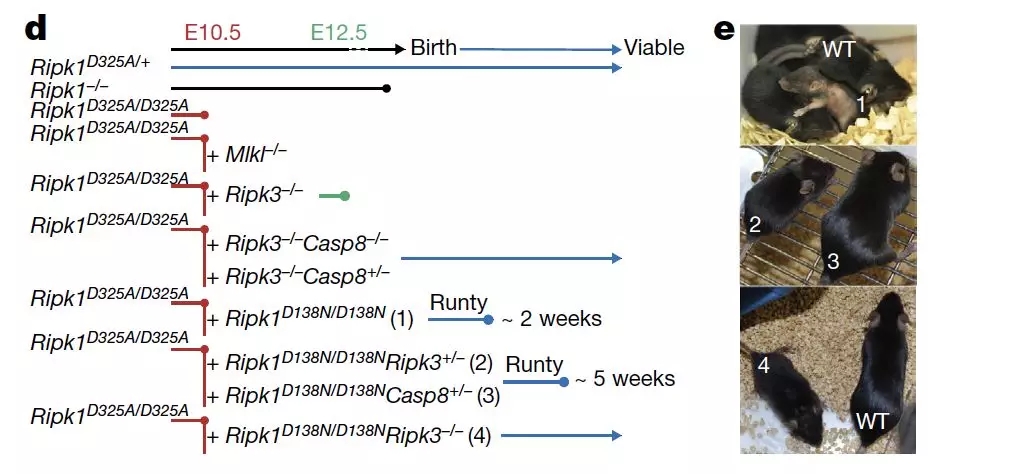
进一步,作者希望了解上述突变与小鼠胚胎致死表型之间的关系。为此,作者构建了不同的突变体小鼠以及杂交组合。
当仅仅存在 RIPK1D325A 纯合突变的时候,小鼠往往在胚胎的第 10 天便死亡。
有趣的是,缺失 MLKL 并不能够挽救这一致死表型,而缺失 RIPK3 则能够延长小鼠的胚胎存活时间。
因此,作者认为在 RIPK1 突变引发的的致死表型中,RIPK3 或许具有与 MLKL 不同的作用,这一作用可能与坏死性凋亡无关。
另一方面,抑制 RIPK1 的激酶活性(D138N)却能够很大程度上挽救小鼠的胚胎致死表型,说明 RIPK1 的激酶属性在导致小鼠胚胎致死中具有一定的影响。
为了在分子机制上证明这一猜想,作者比较了不同类型的 RIPK1 突变体细胞在受到外源性细胞死亡刺激时的反应。
结果表明,相比野生型细胞,RIPK1 D325A 突变使得细胞对外源性刺激更加敏感,而这一效应能够被 RIPK3 缺失突变或者 RIPK1 激酶活性缺失突变所抑制。
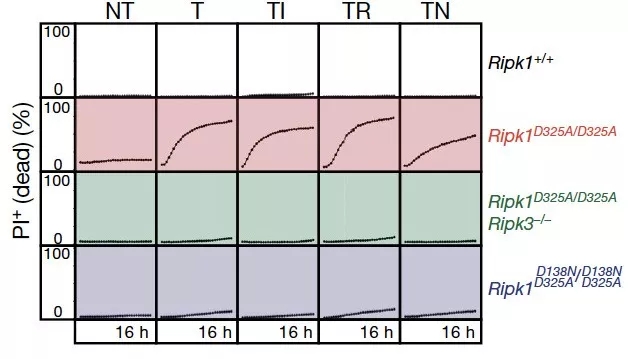
图片来源:Nature
最后,作者分别通过体外细胞实验以及体内小鼠实验,证明了 RIPK1 的正常切割能够抑制炎症反应,从而解释了为什么 RIPK1 的切割位点的突变会导致患者出现反复发作的自体免疫症状。
亮点分析
总之,以上两篇研究结合临床实例、高通量筛选,分子检测以及细胞与动物模型等手段,全方位地揭示了 RIPK1 的切割异常对自体免疫疾病发生的影响。
与此前报道的因 RIPK1 突变导致免疫缺陷的症状不同,本研究将 RIPK1 突变导致的过度活化与自体免疫疾病联系起来,为 RIPK1 在天然免疫信号调节中的功能提供了新的见解。
RIPK1 位于 TNFR1 信号下游,此前研究表明 RIPK1 存在包括泛素化,磷酸化等在内的多种「翻译后修饰」机制,并且分别参与了多种不同类型的天然免疫信号转导过程。
Caspase 8 作为经典外源性细胞凋亡的关键分子,介导了由 TNFR1 活化、FADD 聚集体形成后所传递的促凋亡信号,进而引发下游 caspase 3 等在内的激酶的活化以及细胞凋亡的发生。
此前研究认为 RIPK1 作为与 TNFR1 直接相互作用的蛋白,能够调控 caspase 8 引发的细胞凋亡(当然,同时也能够调控由 RIPK3,MLKL 引发的细胞坏死性凋亡)。
然而,本研究揭示了 Caspase 8 对 RIPK1 的反向调节机制,使得整个 TNFR1 下游的信号调节网络变得更加完整。
近年来,高通量测序在临床诊断中的应用已经变得十分普遍。本文介绍的两篇重磅文章就是其中很好的典范。
通过高通量测序,能够对以往病因不清的症状进行准确的诊断,不仅有助于加深对疾病的理解,更加有助于疾病的治疗。希望今后高通量测序能够在基础医学研究与临床转化之间发挥更重要的作用。
相关研究
事实上,RIPK1 活性受到 Caspase 8 调节这一观点并不新鲜。
仅仅数月之前,由来自 Genentech 公司的科学家,天然免疫信号调节领域的领袖 Vishva M. Dixit 团队在 Nature杂志发表文章,揭示了 Caspase 8 切割 RIPK1 对细胞凋亡以及坏死性凋亡的调节作用 6。
也正是这篇文章发现了 caspase 8 对 RIPK1 的切割位点以及在细胞命运方面的决定性影响,从而一定程度上理清了长期以来 Caspase 8、RIPK1/3、MLKL、等分子之间错综复杂的关系。
由于三篇文章发表时间十分接近,因此在原创性方面均具有相同的贡献。

图片来源:Nature
周青博士是浙江大学生命科学学院的研究员,博士生导师。长期以来,周青博士致力于通过包括外显子测序在内的高通量生物信息学手段挖掘临床相关疾病的发病机制以及诊断标志物。很多原创性的工作发表在包括 New England Journal of Medicine、Nature Genetics 等多篇高水平杂志上。
参考文献
1. Yuan, J., Amin, P. & Ofengeim, D. Necroptosis and RIPK1-mediated neuroinflammation in CNS diseases. Nat. Rev. Neurosci. 20, 19–33 (2019).
2. Zhang, X., Dowling, J. P. & Zhang, J. RIPK1 can mediate apoptosis in addition to
necroptosis during embryonic development. Cell Death Dis. 10, 245 (2019).
3. Newton, K. et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature 574, 428–431 (2019)
4. Tao P. et al. A dominant autoinflammatory disease caused by non-cleavable variants of RIPK1. Nature (2019)
5. Lalaoui et al. Mutations that prevent caspase cleavage of RIPK1 cause autoinflammatory disease. Nature (2019)
6. Newton, K. et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature 574, 428–431 (2019)