简介
研究背景
着丝粒是与有丝分裂纺锤体微管连接的特殊染色体区域,招募特定区域的核小体,其中着丝粒组蛋白变体即指用酵母中的 Cse4 取代了规范组蛋白 H3 后的产物。可以使用含 Cse4 的核小体进行原子结构测定,这是着丝点-核小体复合物的机理和结构研究的起点。
在核小体的早期研究中,人们使用内源性来源的染色质,如鸡红细胞或大鼠肝脏进行提取。但近年来出现了新的标准方案,可以使用单个非洲爪蟾组蛋白表达作为包涵体,进行变复性的纯化后完成组蛋白八聚体的重折叠来得到组蛋白。这种方法也使得核小体和着丝粒-核小体复合物得到了各种高分辨率X射线晶体结构,从而进行一系列的机制研究。
原理
实验流程
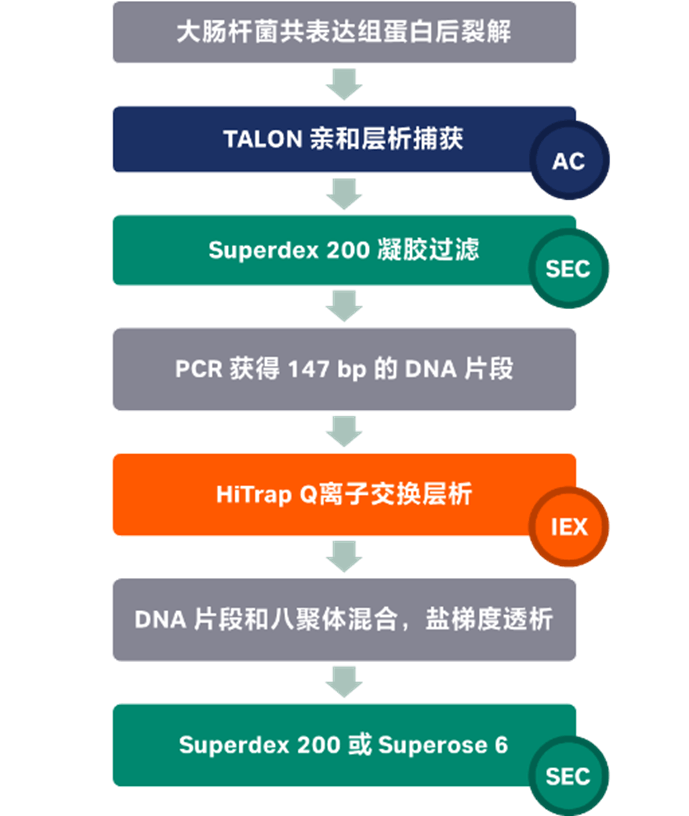
图 1 大肠杆菌组蛋白提纯流程图
材料与仪器
步骤
实验方法
组蛋白八聚体的纯化:将 H2A,H2B,H4 和 H3 的变体 Cse4(来源于酿酒酵母)共同设计在质粒上进行共表达,质粒通过测序验证后在 Rosetta 2 E. coli cells 中表达,生长在 37°C 下以 220rpm 振荡培养。通过离心收获细胞,重悬于含有蛋白酶抑制剂的 HSB 高盐缓冲液(2M NaCl,50mM HEPES pH 7.5,10% 甘油,1mM TCEP)中,并直接在 -80°C 下冷冻储存。
将细胞重悬于高盐缓冲液中并通过超声裂解,裂解物以 40000xg,20°C 条件下离心 1h。将上清液与 4 mL TALON 金属亲和填料一起孵育,并在 4°C下搅拌孵育1小时。转移到重力柱中洗涤后,用含有 50 mM EDTA 和 400 mM 咪唑的 HSB 高盐缓冲液洗脱蛋白质。将洗脱液进行超滤浓缩(10000 MWCO)后于 3000xg,4°C 下离心 15 分钟,直到体积小于 2mL。浓缩后的洗脱液使用层析的方法纯化:在 120mL Superdex 200 分子筛层析柱上纯化去除杂质,得到组蛋白八聚体,并使用 SDS-PAGE 考染检查产物的纯化情况。
DNA 片段的纯化:通过 PCR 产生 147bp 的 Widom601 DNA 序列,在 HiTrap Q 离子交换柱上进行 DNA 片段纯化。
核小体的制备:DNA 和组蛋白八聚体以 1.1:1.0 摩尔比混合。采用盐梯度透析法制备核小体,60°C 下梯度处理 4h 以上。随后使用 24 mL Superdex200 或 2.4 mL Superose6 分子筛层析柱进一步纯化核小体,去除多余的 DNA。分子筛层析缓冲液为 30 mM HEPES pH 7.4、150 mM NaCl 和 1 mM TCEP。
通过以上方法制备了酵母着丝粒核小体后,进行了冷冻电镜下的结构解析与相关作用机制的研究。
内容来源:Cytiva
来源:丁香实验




