简介
研究背景
纯化后的蛋白酶如果固定在填料上,会比游离的具有更长的稳定性,耐受广泛的温度条件、pH 范围、化学试剂,同时可以多次使用,提高底物/酶的比例,提高酶的使用效率和寿命。Ulp1 是 SUMO 标签重组蛋白常用的标签切除蛋白酶,将 Ulp1 偶联到 NHS 预活化填料上,能够极大地提高酶的适用条件和酶的稳定性。利用固定化的 Ulp1 酶和游离的酶进行活性对比,发现固定化的 Ulp1 酶可以耐受高达 15% DMSO 的缓冲液环境,但是游离的 Ulp1 在 5-15% DMSO 环境下,酶活受到了明显的抑制。固定化了的 Ulp1 酶比游离的酶更具有热稳定性,在 37 度存放 24 h 后,游离的酶只剩 16% 活性,存放 36 h 后只剩 14% 活性,而固定化的酶在 37 度存放 36h 仍具有 96% 活性。游离的酶在 pH 10.5 只具有 23% 活性,而固定化的酶在 pH 10.5 具有 100% 活性。固定化的 Ulp1 酶经过测定在使用了 15 次后,仍具有 90% 活性。诸多测试表明蛋白酶被预活化填料偶联固定后,稳定性,酶活条件和寿命明显变优。
原理
实验流程
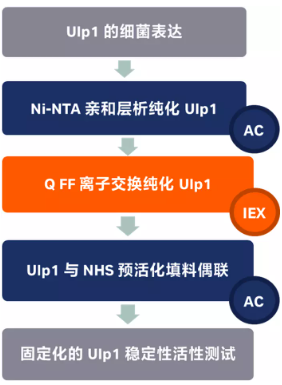
图一 实验流程图
材料与仪器
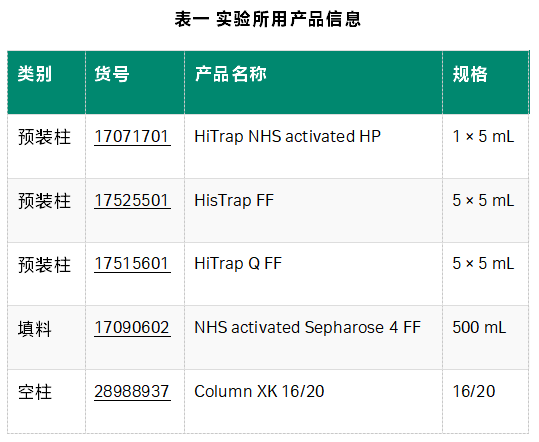
步骤
实验方法
带 HIS 标签的 Ulp1 (403-621) 构建到载体后用大肠杆菌原核表达后,破碎的菌体用 Ni 柱进行捕获,然后经过 QFF 纯化,按照说明书的操作流程将纯化后的 Ulp1 与 NHS,CHO 和 CNBr 三种预活化填料偶联,考察偶联效率,最终筛选出 NHS 最适合偶联 Ulp1 酶,偶联量为 1 mL 的填料偶联了 1.68 mg 的 Ulp1 酶。
内容来源:Cytiva
来源:丁香实验