简介
克隆确认和亲和力鉴定就是利用 c-myc 的表达来签定先前分选的单个克隆是否真正的抗原结合物。且表达全长 scFv。
原理
克隆确认和亲和力鉴定的基本原理是是利用 c-myc 的表达来签定先前分选的单个克隆是否真正的抗原结合物。且表达全长 scFv。每个样本均要用加抗原和不加抗原染色:
不加抗原:抗 c-myc+GaM-Alexa 488+SA-PE;
加抗原:抗 c-myc/GaM-Alexa 488+抗原/SA-PE
材料与仪器
器材:离心机、流式细胞仪等。
试剂:
①酵母菌;
②抗 c-myc 抗体(克隆号为 9E10)(Amersham Biosciences,皮斯卡特维,新泽西州;or Co-vance,Babco,坎伯兰,弗吉尼亚州);
③XXX。
步骤
克隆确认和亲和力鉴定的基本过程可分为如下几步:
(一)单个克隆的流式细胞术染色
A 准备 1-(1~2)x106 酵母菌,用 1 mL 缓冲液洗涤诱导的酵母菌 1 次。
B 用 100μl 含 1μl 抗 c-myc 单克隆抗体重悬酵母菌,并加入用于标记抗原的生物素化抗原(一般为 100nM)。
C 室温孵育 30 min,再冰浴 5 min 后,高速离心沉淀 10s,用 500μl 缓冲液洗 2 次。
D 加入 100μl1:200 稀释后的二抗(GaM-Alexa 488 和 SA-PE),重悬细胞,图 17-4 显示可以使用的几种荧光素的组合方式。
E 冰浴 30 min,离心收集细胞,再用冰预冷的缓冲液洗 2 次。
F 用 1 mL 缓冲液重悬细胞,在流式细胞术分析前持续避光冰浴。
(二)使用平衡结合滴定曲线确定平衡解离常数 K,进行亲和力测定
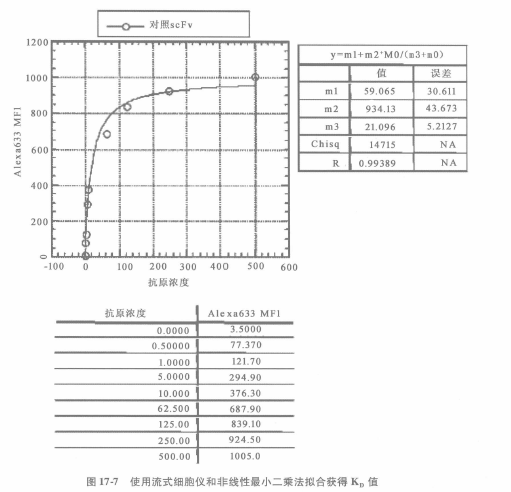
由于起始筛选是在 100nM 基础上完成,来自非免疫性基因文库的绝大多数克隆亲和力范围在 1~100nM。初始选择抗原浓度越低,其亲和力范围越低,通常分离的特定的克隆就越少。一旦通过抗原结合试验确认,我们利用 PCR 扩增 scFv 基因-BstN1 限制性酶切 DNA 指纹图谱法检测克隆唯一性。这样限制了我们需要确定 K,的克隆数,因为许多克隆被前述的 BstN1 指纹图谱证实为完全相同的。酵母菌表面亲和力范围可通过测定在平衡时不同浓度结合的抗原量来确定。该方法取决于在各种抗原浓度下,对 c-mye 阳性酵母菌表面结合抗原的平均荧光强度(MFI)的测定,K,的测定是通过测定酵母菌表面有一半 scFv 结合抗原时的抗原浓度来确定的。因此,需要测定未结合抗原的酵母菌 MFI 值和导致酵母菌最大 MFI 值的抗原浓度,这一测定很容易。通过设置一系列抗原浓度,并用其标记酵母菌,然后用流式细胞仪检测结合抗原细胞群的 MFI 来完成。用流式细胞仪测得每个抗原检测浓度的 MFI,然后再用非线性最小二乘法拟合数据,绘制相对于抗原浓度的曲线图,从而得到 K,值(图 17-6 和图 17-7)。
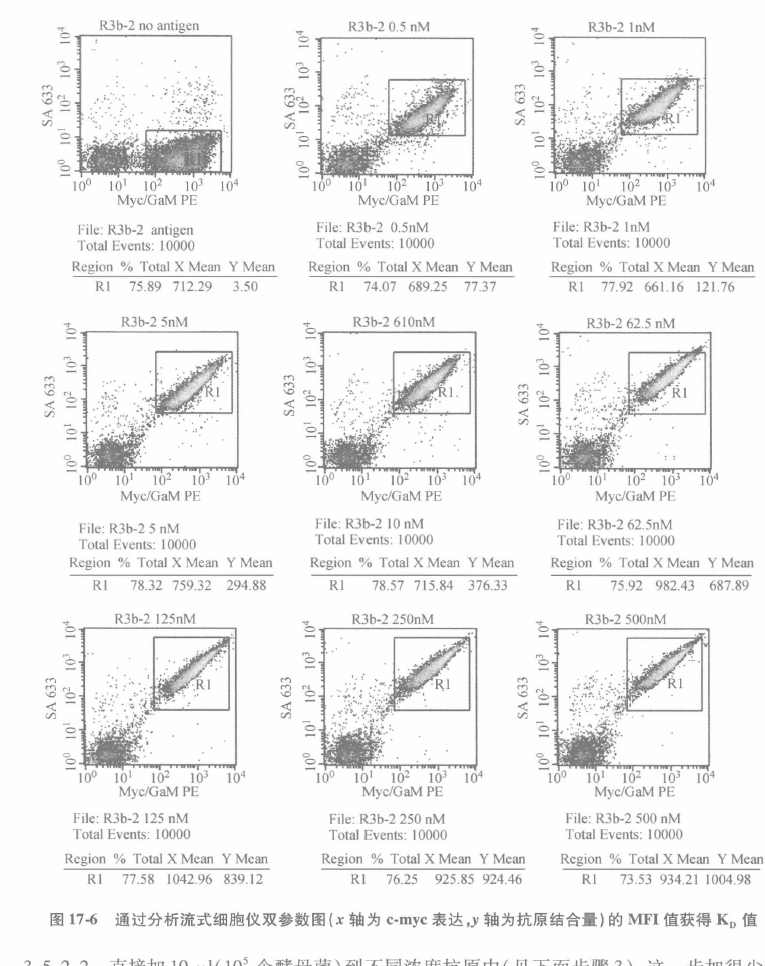
标记 105 酵母菌/抗原浓度代表样本中约有 109~1010 抗原结合位点(scFv),我们设定 105scFv/酵母菌和 50% 表达 scFv。必须保持超过 scFv 分子数量至少 10X 过量抗原分子,即为非耗尽配体状态。我们常规准备 12 个克隆,用 96 孔微量反应板设置 8 个抗原浓度,其中包括非抗原对照作为本底。
A 用 1:100 稀释的抗 c-myc 单克隆抗体(浓度为 200 μg/mL)标记 106 诱导过的酵母菌,冰浴 30 min。
B 直接加 10μl(105 个酵母菌)到不同浓度抗原中(见下面步骤 3),这一步加很少量的 c-myc 抗体,1μl/100 mL/10°细胞。
C 下列抗原浓度和体积可用来测定亲和力在 1~100nM 之间的精确 K。值。105 酵母菌/样本=5109scFv。如果实验者对要测定的亲和力有一定的预计,则可以省略第一个或最后一个的抗原浓度,例如,对于一个 100nM 亲和力,不需要 1nM 或 0.5nM 抗原浓度;对于一个 5nM 亲和力,则不需要 500nM 或 100nM 抗原浓度。可设法在高于或低于 5~10XK,值做一系列 2 倍到 5 倍比稀释。
D 样本室温育 1 h,这为洗脱率为 10-3 的抗体克隆结合反应达到 90% 平衡提供充裕的时间。10-3 洗脱率是指一般为克隆亲和力为 10nM 时的 K,值,代表文库中主要克隆的亲和力。对于洗脱率较低的克隆,如 10-4 或 10-5,与抗原一起孵育 10~24 h,即可达到 90% 平衡。这代表 nM 和亚 nM 亲和力的抗体。
E 置样品冰浴 5 min,大幅度降低温度以降低洗脱率。温度降低 25℃,洗脱率则会减少 50~100 倍。
F 用 500μl 冰预冷的洗涤缓冲液洗 2 次。
G 用 100μl1:200 稀释后的二抗(GaM-Alexa 488 和 SA-PE)重悬细胞。
H 冰浴 30 min,离心收集细胞,再用 500μl 用冰预冷的洗涤缓冲液洗 2 次。
I 用 500μl 缓冲液重悬细胞,在流式细胞术分析前持续避光冰浴。
J 在能检测 Alexa 488(发射波长约为 525nm,通常在 BD 和摩尔特公司生产的流式细胞仪上采用 FL1 荧光通道)和藻红蛋白(发射波长约为 575nm,通常在 BD 和摩尔特公司生产的流式细胞仪上采用 FL2 荧光通道)的双参数图上收集 10000 个细胞。
K 对 c-myc+/抗原+细胞群进行统计学分析。
L 使用非线性最小二乘法绘制 MFI 相对于抗原浓度曲线图,使用下列公式获得 Kp 值:
y=m1+mundefinedm0/(m3+m0)
m1=无抗原对照 MFI,m2=饱和状态 MFI,m3=Kp,如获得的 R 值≥0.998 则 K,精确度在 30% 以内。
来源:丁香实验