染色质免疫沉淀技术(转录调节蛋白与DNA的结合分析实验)
相关实验:转录调节蛋白与 DNA 的结合分析实验
别名:Chromatin immunoprecipitation,ChIP,染色质免疫沉淀技术,交联反应,CHIP
最新修订时间:
简介
染色质免疫沉淀技术,是研究体内蛋白质与DNA相互作用的另一种常用技术。与前述的EMSA不同,ChIP技术可以真实地反映蛋白质分子在体内与基因组DNA结合的状况。
原理
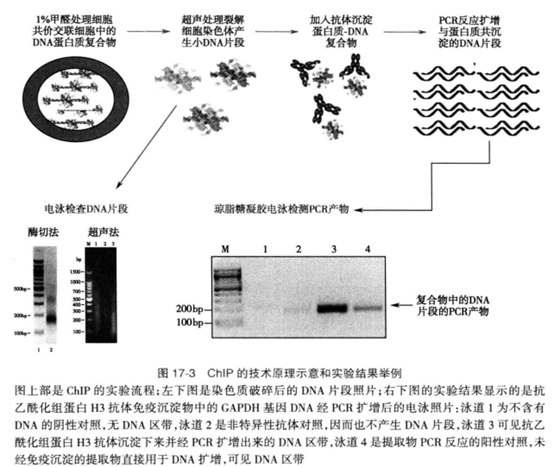
染色质免疫沉淀技术的基本原理是利用特异性抗体沉淀拟研究的目标蛋白,富集在细胞内与此蛋白相结合的DNA片段并分析该片段序列。通过鉴定所获得的DNA片段,可确定该种蛋白在细胞内所结合的DNA序列;同时还可以对复合物中蛋白质分子的结构及化学修饰进行鉴定。图解示意如下图17-3。
用途
染色质免疫沉淀技术可用于研究目的蛋白与已知DNA靶序列间的相互作用,发展到研究目的蛋白与整个基因组未知序列的相互作用;从研究一个目的蛋白与DNA的相互作用,发展到研究结合在DNA序列上的蛋白质复合物。该技术还可以鉴定启动子区域位点特异性的组蛋白的化学修饰。
材料与仪器
步骤
染色质免疫沉淀技术的基本过程可分为如下几步:
(一)蛋白质-DNA复合物的化学交联
常用甲醛进行生物大分子复合物的化学交联。甲醛能够进入细胞,使蛋白质与DNA或蛋白质与蛋白质之间发生共价交联,稳定细胞内原本形成的复合物。
A. 室温下用PBS离心漂洗培养细胞2次,并重悬浮至约 5 x 105 cells/ ml (细胞总数约2 X107), 加入甲醛,至终浓度为1% (每 4 ml 培养液中加入 37% 甲醛 67.5 µl), 室温10 min。
注意事项:控制交联时间。
B. 加入终浓度 0.125 mol/L 的甘氨酸以终止交联反应 。
C. 离心沉淀细胞,用冰 PBS 漂洗1次。
D. 用 6 ml 细胞裂解液重悬细胞。
E. 离心2000 r/min, 5 min 后收集核粗提取物沉淀 。
F. 用 PBS 再次漂洗沉淀,沉淀可用于下一步操作或 -20 ℃冷冻储存 。
(二)染色质的破碎
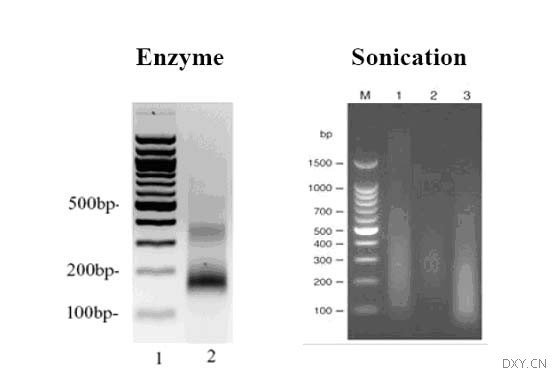
细胞内染色质中DNA的长度将影响免疫沉淀效果和DNA片段的获得,为此可以使用超声物理破碎或限制性内切核酸酶酶切消化,以获得所需长度的DNA片段。
A. 用1.9 ml高盐裂解液重悬浮沉淀,然后移入2 ml的微量离心管以备超声。采用预先选择的最佳条件超声处理。
B. 4 ℃、10000 r/min离心15 min, 保留上清,进行蛋白质浓度测定。
注意事项:提前预冷离心机。
C. 使用含100-500 µg蛋白质的超声破碎的核提取物,加入50 µl蛋白A/G-琼脂糖珠,4 ℃下孵育30 min去除非特异性结合成分。4 ℃最大速度离心5 min。
D. 在上清液中加入第一抗体,并在4 ℃下孵育过夜。
E. 加入50 µ1 A/G PLUS-Agarose并置于4 ℃孵育2 h,12000 r/min离心20 s, 收集球珠并置于冰上。
F. 用1 ml高盐细胞裂解液漂洗球珠2次,用漂洗缓冲液漂洗沉淀4次,用400 µl洗脱液重悬浮球珠。
G. 将试管置67 ℃水浴2 h以打开交叉联接,期间混匀数次。离心后移去球珠,上清液继续置于67 °C过夜。10000 r/min离心3 min移去残余球珠,保留上清。
H .用500 µ1石炭酸/氯仿/异戊醇(25:24:1)提取含有DNA的上清液1次,充分混匀。14000 r/min离心3 min使两相分离,保留水相,然后用100 µ1TE提取有机相1次,并入水相。
I. 用600 µ1石炭酸/氯仿/异戊醇再提取混合的水相。
J. 可用商品化的试剂盒浓缩DNA。
洗脱液:1% SDS, 0.1 mol/L NaHCO3;
(三)免疫沉淀
与大多数免疫沉淀实验相同,抗体的特异性和亲和力对于是否获得足够纯度的靶蛋白及与之相结合的DNA片段至关重要。
(四)DNA鉴定
注意事项
2. 破碎DNA是ChIP实验成功与否的重要因素,超声破碎效果与细胞类型、细胞浓度及裂解液成分等因素有关。超声处理后的提取物的液体应从浑浊状态变为透明状态。实验前,应试用不同超声时间和强度,确定将DNA切割至大小约200-500 bp的最优条件。
3. 抗体的非特异性结合导致大最的非目标靶点DNA片段随之沉淀,造成假阳性,从而掩盖了真实的蛋白质结合位点信息;而亲和力较差的抗体,则无法有效地沉淀DNA结合蛋白及其靶点DNA片段。
另一方面,在甲醛交联过程中,蛋白质构象会受到影响,可能会掩盖一些蛋白质的表位,影响到部分蛋白质和DNA复合体的免疫沉淀反应。
因此,一些适用于蛋白质印迹或免疫组化的抗体,并不能保证一定能够成功地进行ChIP实验,需要充分尝试可利用的抗体,以获得最佳效果。尽可能选取验证过的ChIP或IP级别特异性抗体。
来源:丁香实验