简介
电泳迁移率变动分析,也称凝胶迁移率变动分析,该方法是用于检测 DNA结合蛋白、 RNA 结合蛋白,并可通过加入特异性的抗体来检测特定的蛋白质,并可进行未知蛋白的鉴定。
原理
电泳迁移率变动分析的基本原理是大分子电泳迁移率的变化显示蛋白质与DNA的结合。由于蛋白质、核酸等在凝胶中的电泳迁移率取决于其大小、形状和电荷,电泳迁移率的差异可显示出分子结构或结合组分的不同,因而可用于观察分子(如蛋白质、核酸)间的相互作用。
例如:将特定的一段DNA分子(用放射性核素示踪)与细胞核提取物孵育后进行电泳,如果核提取物中存在能与这一段DNA序列特异结合的蛋白质因子,就会有大分子复合物的形成,电泳时DNA片段就会出现迁移率降低、区带滞后的现象。
用途
电泳迁移率变动分析可用于用于研究 DNA 结合蛋白与相应 DNA 序列间的相互作用,也可用于定性和定量分析,目前已经成为转录因子研究的经典方法。
材料与仪器
步骤
电泳迁移率变动分析的基本过程可分为如下几步:
(一)核蛋白提取物的制备
用于DNA结合分析的EMSA实验的蛋白质样品可以是纯化蛋白质、部分纯化蛋白质或核细胞抽提液。
A.培养细胞至适当密度,用预冷的PBS洗涤细胞2次,吸干净余液。加适量PBS,将细胞刮下。
B.4 °C、500 g离心5~8 rnin,小心吸掉上清。
注意事项:离心机提前预冷。
C. 加400 µl 细胞膜裂解液,涡旋混匀15 s,立即置于冰上15 min。
D.加25 µl 10% NP-40,涡旋混匀15 s,立即置于冰上1 min。
E涡旋混匀5 s,4 ℃、12000 r/min离心30 min。
F.收集上清(胞质蛋白),置于-80 ℃。
G.于沉淀中加入100 µl细胞核裂解液,冰浴放置30 min,间以涡旋振荡。
H.4 ℃、12000 r/min 离心10-15 min。
I.收集上清(核蛋白)至新的离心管,-80 ℃保存。
注:细胞膜裂解液:10 mmol/L HEPES(pH7.9),10 mmol/L KCL, 0.1 mmol/L DTT和0.5 mmol/LPMSF。细胞核裂解液:20 mmol/L HEPES(pH7.9), 400 mmol/L NaCl, 1 mmol/L EDTA,1 mmol/L DTT和1 mmol/L PMSF。
(二)DNA探针的制备
DNA探针目前主要依据候选的结合序列人工设计并合成DNA片段。为在电泳后能够辨认,DNA片段可以用放射性核素32P标记或用生物素进行标记,前者虽然操作较复杂,但敏感度高。用于标记人工合成DNA片段的主要方法是用T4多核苷酸激酶进行的末端标记法。无论是何种标记方法,目前都有商品试剂盒可用。
A.如下设置探针标记的反应体系:
T4多核苷酸激酶(5~10 U/µl) 1µl
按照上述反应体系依次加入各种试剂,加入放射性核素标记的ATP后,振荡混匀,再加入T4多核苷酸激酶,混匀。
B水浴,37 ℃反应10 min。
C加入1 µl探针标记终止液,混匀,终止探针标记反应。
D.加入89 µl TE,混匀。标记好的探针最好立即使用,标记好的探针可以保存在-20 ℃。
注意事项:标记好的探针最长使用时间一般不宜超过3 d。
E使用前,95 ℃变性5~10 min,缓慢退火至室温,使之形成双链以供转录因子结合。
(三)蛋白质提取物与DNA结合反应
将核蛋白提取物或纯化的蛋白质与标记的DNA探针温育,使具有结合DNA探针能力的蛋白质分子与探针形成蛋白质-DNA复合物,电泳分离并自显影后即可确定是否有蛋白质与DNA的结合。
(四)非变性聚丙烯酰胺凝胶电泳及显影
B.电泳:将混合了无色上样缓冲液的样品加入到样品孔内,在多余的孔内加入10 µ1EMSA蓝色上样缓冲液(100% 甘油,0.5 mol/L EDTA、0.5% 溴酚蓝),用于观察电泳进行的情况。
如果感到操作过于困难,可以添加极少量含溴酚蓝的上样缓冲液,至能勉强看到蓝色即可。电泳至蓝色染料溴酚蓝至胶的下缘1/4处,停止电泳,以防自由探针走出凝胶。
注意事项:由于溴酚蓝会影响蛋白质和DNA的结合,建议反应样品尽量使用无色的EMSA上样缓冲液。
注意事项
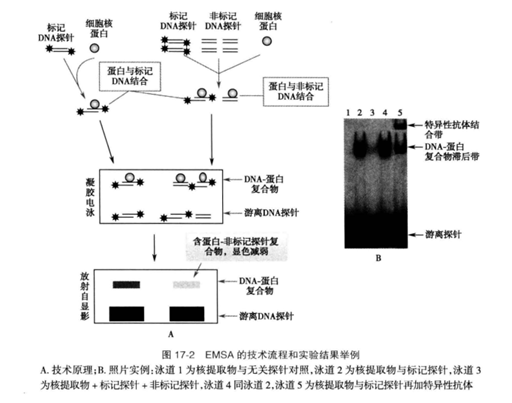
为证明结合反应的特异性,在实验中需要有一系列的对照。首先需要一个不加核蛋白的反应,电泳后只见到游离的DNA探针出现在电泳胶的前沿;如果有蛋白质与DNA片段形成了复合物,标记DNA的迁移就会滞后,可见到移动较慢的DNA-蛋白质复合物区带。
结合的特异性主要依靠无关DNA探针和竞争对照来证明。无关探针(非特异)不能与蛋白质形成复合物,电泳行为与无探针时相同;竞争对照在反应中使用了一定量的未标记DNA探针(冷探针),与标记探针竞争而占据了一些可结合该序列的蛋白质,使得蛋白质-DNA区带的强度明显减弱。
用于竞争的未标记探针也被称为竞争DNA(competitor DNA)。如果结合在该DNA探针上的是已知蛋白质时,还可以在反应中加入特异性抗体,该抗体将结合在原有的蛋白质-DNA复合物上,使之电泳迁移更加缓慢,称为super-shift。
来源:丁香实验







