简介
对胰岛功能不仅可以体内评估,也可以将胰岛分离出来在培养条件下检测其胰岛素分泌功能,以排除其他组织对整体分析结果的影响,因此分离胰岛作为对胰岛功能独立检测及提取蛋白质或 RNA 用于分子研究都是极为有用的基本操作。
原理
小鼠胰岛的分离纯化实验的基本过程可分为如下几步:
A. 将小鼠用引颈法处死,快速打开腹腔,在体式显微镜下找到胆总管,在靠近十二指肠的部分用手术线将胆总管结扎。
B. 将肝脏上翻,分离胆总管,将其上附着的脂肪轻轻剥离。用显微镊夹住胆总管的上端(靠近肝脏),然后用 4 号半的医用头皮针插入胆总管,用 5 ml 注射器连接头皮针通过胆总管往胰腺灌注预冷的 collagenase 溶液(1 mg/ml collagenase in HBSS,ice-cold)。一般推注 2~3 ml collagenase 溶液可以使小鼠的胰 腺充分膨胀。
C. 将充分膨胀的胰腺分离出来,放入 50 ml 离心管中,再加入 collagenase 溶液 2 ml,置于 37 ℃ 水浴消化 28 分钟。消化期间轻轻摇动离心管,使消化充分。注意:消化的时间和水浴温度都很重要,要尽可能准确。
D. 消化结束后,把离心管置于漩涡振荡器上振摇 10 秒,此时胰腺已经被分解成糜状组织,加入 15 ml 预冷的 HBSS,摇匀以终止消化。
E. 4 ℃,1000 r/min 离心 30 秒,倒掉上清液。
F. 将沉淀用 10 ml 预冷的 HBSS 重悬洗涤,不要用漩涡振荡器,用 1 ml 移液器轻轻将沉淀重悬。将重悬后的悬浊液移入 10 ml 离心管中。在 4 ℃,1000 r/min 离心 30 秒,倒掉上清液。
G. 将上一步所得的沉淀用 5 ml Histopaque 1077 重悬,不要用漩涡振荡器,用 1 ml 移液器轻轻将沉淀重悬。然后用 10 ml 注射器轻轻加入 5 ml 预冷的 HBSS,轻柔加入,使 HBSS 沿着管壁轻轻滑下。加完后,下面 5 ml 为 Histopaque,上面 5 ml 为 HBSS,因为两种液体密度的差异,中间能形成清晰界面。
H. 在 4 ℃,2200 r/min 离心 30 分钟。注意:在此步骤的离心中,需要将离心机的加速和减速都调整到最慢速度,且用水平转子而不能用角转子。
I. 离心结束后取出离心管,可以看见在管中央,不同密度液体的界面处分布着一层沙状的白色小颗粒,即为初步分离纯化的胰岛。用巴氏吸管小心吸出中间层的胰岛,用预冷的 HBSS 洗涤:将吸出的胰岛置于 5 ml 预冷的 HBSS 中,用手轻轻敲打管子,使胰岛分散均匀。然后在 4 ℃,以 1000 r/min 离心 30 秒,将上清弃掉。用预冷的 HBSS 按上述步骤重复洗涤一遍。
J. 将洗涤后的胰岛用含有 10% 胎牛血清的 RPMI 1640 培养基重悬,然后放置于 6 cm 培养皿中。在体视显微镜下,用 20 μl 移液器挑取胰岛,对胰岛进行进一步分选。注意:之所以要进行此步骤,是因为初步分离的胰岛中含有少量消化下来的胰腺外分泌细胞。
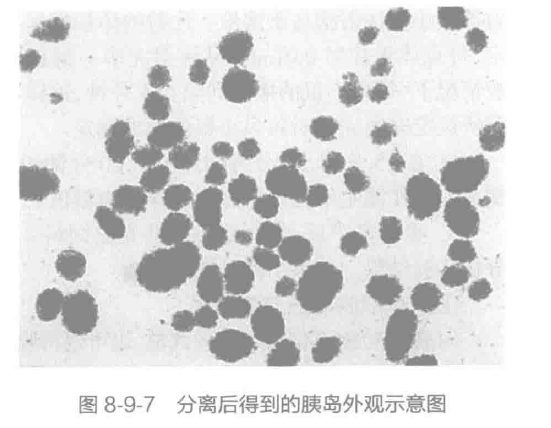
K. 将挑取出来的胰岛放入含有 10% 胎牛血清的 RPMI 1640 培养基中,用 6 cm 培养皿在 5% CO2 的环境下 37 ℃ 于培养箱中培养,以进行下一步的实验。结果示例见图8-9-7。
材料与仪器
步骤
小鼠胰岛的分离纯化实验的基本过程可分为如下几步:
A. 将小鼠用引颈法处死,快速打开腹腔,在体式显微镜下找到胆总管,在靠近十二指肠的部分用手术线将胆总管结扎。
B. 将肝脏上翻,分离胆总管,将其上附着的脂肪轻轻剥离。用显微镊夹住胆总管的上端(靠近肝脏),然后用 4 号半的医用头皮针插入胆总管,用 5 ml 注射器连接头皮针通过胆总管往胰腺灌注预冷的 collagenase 溶液(1 mg/ml collagenase in HBSS,ice-cold)。一般推注 2~3 ml collagenase 溶液可以使小鼠的胰 腺充分膨胀。
C. 将充分膨胀的胰腺分离出来,放入 50 ml 离心管中,再加入 collagenase 溶液 2 ml,置于 37 ℃ 水浴消化 28 分钟。消化期间轻轻摇动离心管,使消化充分。注意:消化的时间和水浴温度都很重要,要尽可能准确。
D. 消化结束后,把离心管置于漩涡振荡器上振摇 10 秒,此时胰腺已经被分解成糜状组织,加入 15 ml 预冷的 HBSS,摇匀以终止消化。
E. 4 ℃,1000 r/min 离心 30 秒,倒掉上清液。
F. 将沉淀用 10 ml 预冷的 HBSS 重悬洗涤,不要用漩涡振荡器,用 1 ml 移液器轻轻将沉淀重悬。将重悬后的悬浊液移入 10 ml 离心管中。在 4 ℃,1000 r/min 离心 30 秒,倒掉上清液。
G. 将上一步所得的沉淀用 5 ml Histopaque 1077 重悬,不要用漩涡振荡器,用 1 ml 移液器轻轻将沉淀重悬。然后用 10 ml 注射器轻轻加入 5 ml 预冷的 HBSS,轻柔加入,使 HBSS 沿着管壁轻轻滑下。加完后,下面 5 ml 为 Histopaque,上面 5 ml 为 HBSS,因为两种液体密度的差异,中间能形成清晰界面。
H. 在 4 ℃,2200 r/min 离心 30 分钟。注意:在此步骤的离心中,需要将离心机的加速和减速都调整到最慢速度,且用水平转子而不能用角转子。
I. 离心结束后取出离心管,可以看见在管中央,不同密度液体的界面处分布着一层沙状的白色小颗粒,即为初步分离纯化的胰岛。用巴氏吸管小心吸出中间层的胰岛,用预冷的 HBSS 洗涤:将吸出的胰岛置于 5 ml 预冷的 HBSS 中,用手轻轻敲打管子,使胰岛分散均匀。然后在 4 ℃,以 1000 r/min 离心 30 秒,将上清弃掉。用预冷的 HBSS 按上述步骤重复洗涤一遍。
J. 将洗涤后的胰岛用含有 10% 胎牛血清的 RPMI 1640 培养基重悬,然后放置于 6 cm 培养皿中。在体视显微镜下,用 20 μl 移液器挑取胰岛,对胰岛进行进一步分选。注意:之所以要进行此步骤,是因为初步分离的胰岛中含有少量消化下来的胰腺外分泌细胞。
K. 将挑取出来的胰岛放入含有 10% 胎牛血清的 RPMI 1640 培养基中,用 6 cm 培养皿在 5% CO2 的环境下 37 ℃ 于培养箱中培养,以进行下一步的实验。结果示例见图8-9-7。

注意事项
1. 在分离胰腺时,通过胆总管的灌注部分很重要,一定要使胰腺尤其是胰尾部分膨胀充分。
2. 在操作中要注意除了 RPMI 1640,所有的溶液在使用前都要提前预冷。
3. 在最后用 20 μl 移液器挑取胰岛时,在室温进行即可,但速度要尽可能快。
4. 正常情况下,每只小鼠能够抽提出 60~80 个中等大小的胰岛,根据不同的实验需要安排所需要抽提的小鼠数目。
来源:丁香实验