简介
二喹啉甲酸法(bicinchoninic acid assay,BCA 法) 是一种类似 Lowry 法的蛋白定量方法,该方法只需一步反应且不易受其他物质干扰。
原理
材料与仪器
步骤
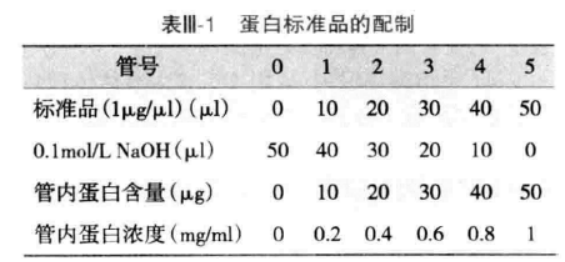
A.准备蛋白标准品 取适量的标准 BSA 溶液(2mg/ml),加入等体积 0.2mol/L NaOH 并混匀,按表 Ⅲ-1 制备不同浓度的蛋白标准品,每个浓度准备 2 管。
B.准备待测蛋白质样品 如为液体样品,样品用 H2O 做不同浓度的稀释(或不稀释)。加入与稀释后样品等体积的 0.2mol/L NaOH,使样品的显色保持在可测量的范围内。如为固体样品,样品以 2mol/L NaOH 溶解,将溶解后的样品用水10倍稀释,再按可检测到的适宜浓度用去离子水稀释样品,使样品的显色保持在可测量的范围内,NaOH 的终浓度为 0.1mol/L。
(1)取 50 倍体积的 A 液,加入 1 倍体积的 B 液,迅速混匀。按照需要的总量配制工作液,配好的工作液于室温放置,1 天内可以使用。
(2)在已准备好的标准品和待测样品中各加入 1.0ml 工作液,立即混匀。
(3)37℃ 恒温水浴 30 分钟(测量范围:20~2000μg/ml),或室温 2 小时(测量范围:20~2000μg/ml),或 60℃ 水浴 30 分钟(测量范围:5~250μg/ml)。
(4)将保温后的所有试管冷却到室温。室温下读取各管在 562nm 波长处的吸光度(As62)。
(5)将标准品管和待测样品管的读数减去空白管读数,得到校正后各管的 As62 值。
(6)以各标准管蛋白含量为横坐标,各标准管的 As62 值为纵坐标,绘制标准曲线。
注意事项
1.过浓的待测样品需要进行稀释 稀释有以下作用:
①降低干扰物的浓度,如必须使巯基乙醇的浓度<0.01%、DTT<1mmol/L、SDS<5%、脱氧胆酸<5%、甘氨酸<lmmol/L、尿素<3mol/L、EDTA<10mmol/L、NaCl<1mol/L;
②使样品完全溶解;
③使呈色反应在碱性环境中进行;
④使呈色后样品的吸光度落在标准曲线的中段,此处测量最可靠;
⑤为了稀释准确,稀释容量不能太小。如做 2 倍稀释,不能取 1μl 样品加 1μl 稀释液,可取 100μl 样品加 100μl 稀释液。每份待测样品至少要做 2 个不同的稀释度。
2.温度 样品加入工作液保温后,必须冷却到室温。最好在 10 分钟内完成所有样品的读数。尽管室温下 BCA 呈色反应还在缓慢发生,但每 10 分钟光吸收值仅增加 2.3%,因此各样品的读数误差不会太大。
来源:丁香实验







