BCA(二喹啉甲酸)蛋白分析法
互联网
9366
一、原理
BCR蛋白分析是一种对样品中总蛋白进行量化的分析方法,原理是在碱性溶液中蛋白质可以将Cu2+还原成Cu1+(双缩脲反应),从而出现明显的紫色,铜离子被还原主要是蛋白质分子中半胱氨酸、胱氨酸、酪氨酸,色氨酸四种氨基酸的作用,然而,与Coomassie燃料结合反应不同的是,一般的多肽键都能形成颜色,从而减少了由于蛋白质不同的变异性。
与Bradford分析实验相比较,BCA实验分析更加客观,普通的肽键就能出现颜色反应,其弊端是其反应容易被蛋白质样品中的某些化学物质干扰,包括还原剂(二硫苏糖醇和硫基乙醇等),铜离子螯合剂(EDTA,EGTA)和高浓度缓冲液,但是这些干扰作用可以通过对蛋白质样品的稀释进行消除。
二、材料与试剂
BCR蛋白分析是一种对样品中总蛋白进行量化的分析方法,原理是在碱性溶液中蛋白质可以将Cu2+还原成Cu1+(双缩脲反应),从而出现明显的紫色,铜离子被还原主要是蛋白质分子中半胱氨酸、胱氨酸、酪氨酸,色氨酸四种氨基酸的作用,然而,与Coomassie燃料结合反应不同的是,一般的多肽键都能形成颜色,从而减少了由于蛋白质不同的变异性。
与Bradford分析实验相比较,BCA实验分析更加客观,普通的肽键就能出现颜色反应,其弊端是其反应容易被蛋白质样品中的某些化学物质干扰,包括还原剂(二硫苏糖醇和硫基乙醇等),铜离子螯合剂(EDTA,EGTA)和高浓度缓冲液,但是这些干扰作用可以通过对蛋白质样品的稀释进行消除。
二、材料与试剂
1. 牛血清白蛋白(BSA)(Sigma)
2. BCA蛋白检测试剂(Pierce)
三、仪器
1. 分光光度计(Tecan)
四、操作步骤
1. 制备BSA标准样。先配制1 ml BSA母液(2 mg/ml,溶于水中),再配制浓度在20-2000 ug/ml 的一系列(5~8)稀释液。
2. 准备BCA工作液(WR)。计算所需工作液的总体积。WR是将BCA试剂A和BCA试剂B按50:1的比例混合(混合液是绿色澄清溶液)。
3. 若在测量管中测定,每个样品需要2.0 ml WR。样品与WR的比例为1:20。
4. 各吸取0.1 ml 标准样和未知蛋白样品,加入标记号的测量管中。设两个一样的空白对照管,一个用于标准曲线,加入0.1 ml H2O来代替BSA。另一个用于蛋白样品,加入0.1 ml 蛋白提取液。
5. 每管中加入2.0 ml WR,充分混匀。
6. 盖上盖子,37℃温浴30 min。
7. 检测前室温放置10分钟。
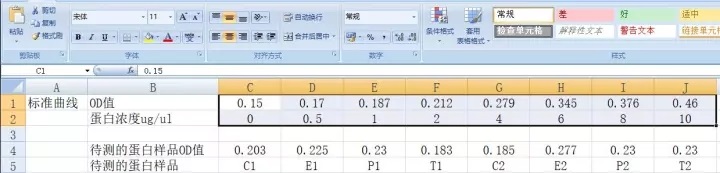
8. 测量OD562的吸光值。
9. 若在微孔板中测定,需要WR试剂。样品与WR的比例为1:8 or 1:20(当样品有限时)。
10. 各吸取25或10 ul 标准样或蛋白样品,加入微孔中。分别以水或蛋白缓冲液作为标准曲线和蛋白样品的空白对照。
11. 没孔中加入200 μl WR。
12. 盖上盖子,37℃温浴30 min。
13. 检测前室温放置10分钟。
14. 使用酶标仪测量OD562的吸光值。