🔥 PCR 反应体系与反应条件
最新修订时间:
合作专家 | 孙齐博士
生理学 首都医科大学
简介
参加 PCR 反应的物质主要有五种,即引物、酶、dNTP、模板和 Mg2+。引物是 PCR 特异性反应的关键,PCR 产物的特异性取决于引物与模板 DNA 互补的程度。理论上,只要知道任何一段模板 DNA 序列,就能按其设计互补的寡核苷酸链做引物,利用 PCR 就可将模板 DNA 在体外大量扩增。
用途
PCR 技术可用于检测基因的表达、测定未知 DNA 区域、制备单链 DNA 用于 DNA 测序等。
材料与仪器
步骤
PCR 反应条件的选择
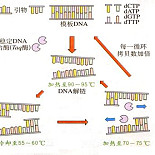
PCR 反应条件为温度、时间和循环次数。
温度与时间的设置:基于 PCR 原理三步骤而设置变性-退火-延伸三个温度点。
1、在标准反应中采用三温度点法,双链 DNA 在 90~95 ℃ 变性,再迅速冷却至 40~60 ℃,引物退火并结合到靶序列上,然后快速升温至 70~75 ℃,在 Taq DNA 聚合酶的作用下,使引物链沿模板延伸。
2、对于较短靶基因(长度为 100~300 bp 时)可采用二温度点法,除变性温度外、退火与延伸温度可合二为一,一般采用 94 ℃ 变性,65 ℃ 左右退火与延伸(此温度 Taq DNA 酶仍有较高的催化活性)。
① 变性温度与时间:变性温度低,解链不完全是导致 PCR 失败的最主要原因。一般情况下,93 ℃~94 ℃ 1 min 足以使模板 DNA 变性,若低于 93 ℃ 则需延长时间,但温度不能过高,因为高温环境对酶的活性有影响。此步若不能使靶基因模板或 PCR 产物完全变性,就会导致 PCR 失败。
② 退火(复性)温度与时间:退火温度是影响 PCR 特异性的较重要因素。变性后温度快速冷却至 40 ℃~60 ℃,可使引物和模板发生结合。由于模板 DNA 比引物复杂得多,引物和模板之间的碰撞结合机会远远高于模板互补链之间的碰撞。退火温度与时间,取决于引物的长度、碱基组成及其浓度,还有靶基序列的长度。对于 20 个核苷酸,G + C 含量约 50% 的引物,55 ℃ 为选择最适退火温度的起点较为理想。引物的复性温度可通过以下公式帮助选择合适的温度:
Tm 值(解链温度)= 4(G + C)+ 2(A + T)
复性温度 = Tm 值 -(5~10 ℃)
在 Tm 值允许范围内,选择较高的复性温度可大大减少引物和模板间的非特异性结合,提高 PCR 反应的特异性。复性时间一般为 30~60 s,足以使引物与模板之间完全结合。
③ 延伸温度与时间:Taq DNA 聚合酶的生物学活性:
70~80 ℃ 150 核苷酸/ S /酶分子
70 ℃ 60 核苷酸/ S /酶分子
55 ℃ 24 核苷酸/ S /酶分子
高于 90 ℃ 时,DNA 合成几乎不能进行。
PCR 反应的延伸温度一般选择在 70~75 ℃ 之间,常用温度为 72 ℃,过高的延伸温度不利于引物和模板的结合。PCR 延伸反应的时间,可根据待扩增片段的长度而定,一般 1 Kb 以内的 DNA 片段,延伸时间 1 min 是足够的。3~4 kb 的靶序列需 3~4 min;扩增 10 Kb 需延伸至 15 min。延伸进间过长会导致非特异性扩增带的出现。
对低浓度模板的扩增,延伸时间要稍长些。循环次数循环次数决定 PCR 扩增程度。PCR 循环次数主要取决于模板 DNA 的浓度。一般的循环次数选在 30~40 次之间,循环次数越多,非特异性产物的量亦随之增多。
注意事项
1. RNA 模板提取一般采用异硫氰酸胍或蛋白酶 K 法,要防止 RNase 降解 RNA;
2. Mg2+ 浓度:Mg2+ 对 PCR 扩增的特异性和产量有显著的影响,在一般的 PCR 反应中,各种 dNTP 浓度为 200 μmol/L 时,Mg2+ 浓度为 1.5~2.0 mmol/L 为宜。Mg2+ 浓度过高,反应特异性降低,出现非特异扩增,浓度过低会降低 Taq DNA 聚合酶的活性,使反应产物减少。
在 PCR 反应中,dNTP 应为 50~200 μmol/L,尤其是注意 4 种 dNTP 的浓度要相等(等摩尔配制),如其中任何一种浓度不同于其它几种时(偏高或偏低),就会引起错配。浓度过低又会降低 PCR 产物的产量。dNTP 能与 Mg2+ 结合,使游离的 Mg2+ 浓度降低。
设计引物应遵循以下原则:
① 引物长度: 15-30 bp,常用为 20 bp 左右;
② 引物扩增跨度:以 200~500 bp 为宜,特定条件下可扩增长至 10 kb 的片段;
③ 引物碱基:G + C 含量以 40-60% 为宜,G + C 太少扩增效果不佳,G + C 过多易出现非特异条带。ATGC 最好随机分布,避免 5 个以上的嘌呤或嘧啶核苷酸的成串排列;
④ 避免引物内部出现二级结构,避免两条引物间互补,特别是 3' 端的互补,否则会形成引物二聚体,产生非特异的扩增条带。
⑤ 引物 3' 端的碱基,特别是最末及倒数第二个碱基,应严格要求配对,以避免因末端碱基不配对而导致 PCR 失败;
⑥ 引物中有或能加上合适的酶切位点,被扩增的靶序列最好有适宜的酶切位点,这对酶切分析或分子克隆很有好处。
⑦ 引物的特异性:引物应与核酸序列数据库的其它序列无明显同源性。
来源:丁香实验