4 个回答
Lv花开花落
有帮助
- 胶的凝结不好,例如有花纹特别是浓度高的胶在冬天温度较低的情况下,在分离胶的下部有波浪样的花纹,凝胶不均匀。解决方法:加大TEMED和过硫酸胺的量,使其凝结速度加快。同时洗干净玻璃板,防止有残留的胶干结在玻璃板上。
- 胶不凝,解决方法:温度较低时加大TEMED和过硫酸胺的量,过硫酸胺必须新鲜配制。如若还是不行重新配制一下缓冲溶液。
- 胶易碎,例如浓度较高的胶在染色和脱色过程以及扫描过程中破裂。解决方法:首先在上述过程中一定要动作轻缓,其次在室温较高的情况下可以适当减少TEMED和过硫酸胺的量。
- 电泳完后胶上有很多长条纹的杂带,解决方法:建议电泳缓冲液不要回收利用。配制胶的溶液一定要纯。
-
2.凝胶时间不对
通常胶在30分钟到1小时内凝。如果凝的太慢,可能是TEMED,AP剂量不够。 如果凝的太快,可能是AP和TEMED用量过多,此时胶太硬易裂,电泳时易烧胶。
3.浓缩胶与分离胶断裂、板间有气泡对电泳的影响
前者主要原因是拔梳子用力不均匀或过猛所致;后者是由于在解除制胶的夹子后,板未压紧而致空气进入引起的,一般对电泳结果不会有太大的影响。
4.样品的处理
根据样品分离目的不同,主要有三种处理方法:还原SDS处理、非还原SDS处理、带有烷基化作用的还原SDS处理。
- 还原SDS处理:在上样buffer中加入SDS和看DTT(或Beta巯基乙醇)后,形成SDS与蛋白相结合的分子。
- 带有烷基化作用的还原SDS处理:碘乙酸胺的烷基化作用可以很好的保护SH基团,得到较窄的谱带;另碘乙酸胺可捕集过量的DTT,而防止纹理现象的产生。100uL样品缓冲液中加入10uL20%的碘乙酸胺,并在25℃下保藏30min。
- 非还原SDS处理:生理体液、血清、尿素等样品,一般只用1%SDS沸水中煮3min,未加还原剂,因而蛋白折叠未被破坏,不可作为测定分子量来使用。
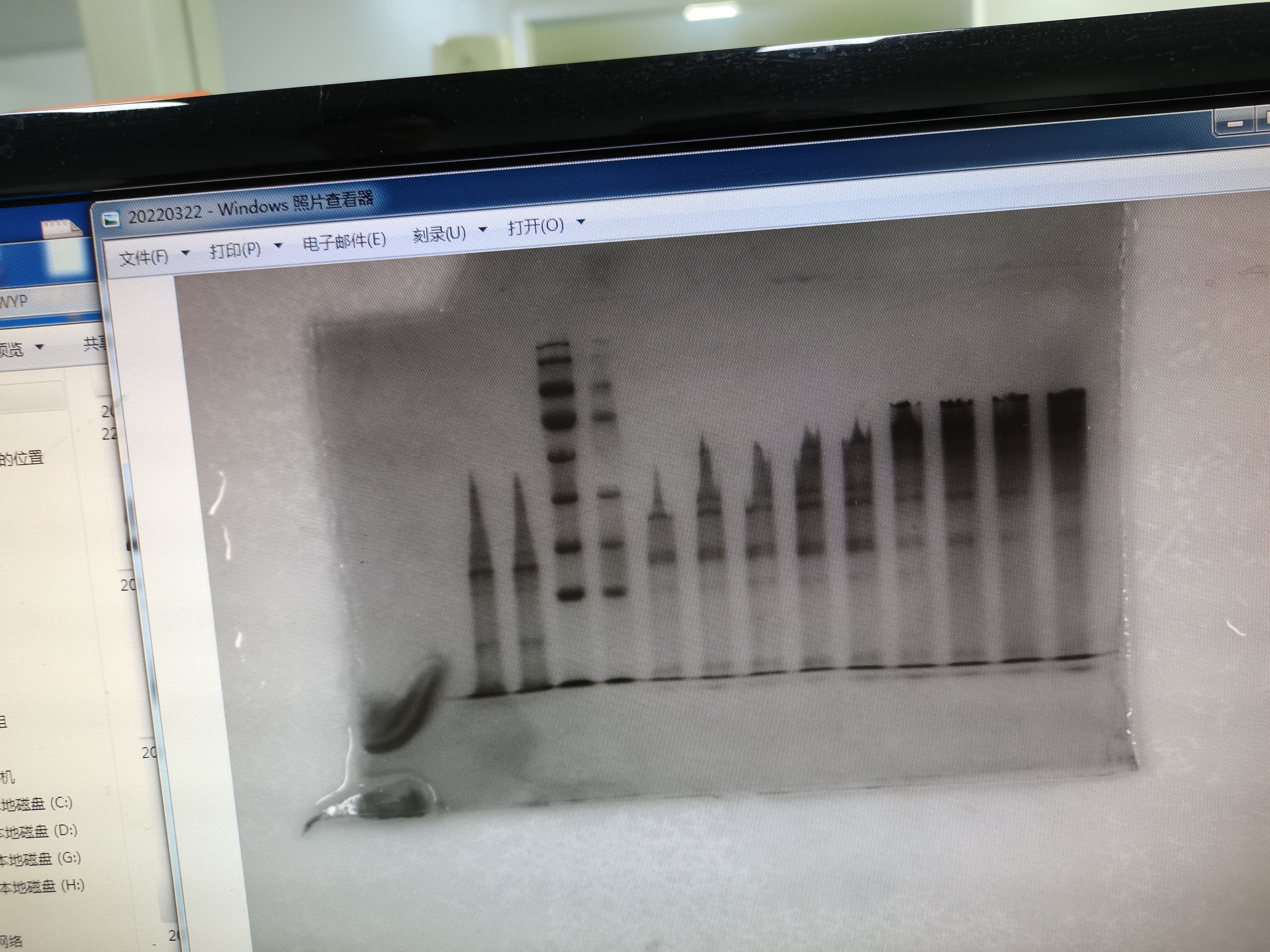
5.条带两边翘起中间凹下的原因(︶)
在较厚的凝胶中,由于凝胶不均匀冷却,中间部分凝固不好。
电泳系统温度偏高。
处理办法:待其充分凝固再作后续实验。
6.条带两边向下中间鼓起的原因(︵)
一般原因是两板之间的底部间隙气泡未排除干净,或聚合不完全。
处理办法:可在两板间加入适量缓冲液,以排除气泡。
天一湖医者
有帮助
可以考虑是一抗或者二抗浓度过高。
bamboopiggy
有帮助
是你的玻璃板和胶之间有缝隙了。考虑换一下玻璃板
whilt-shirt
有帮助
有可能是样本降解了,建议重新提蛋白
相关产品推荐
相关问答
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序