qPCR各样本间内参差值控制在多少才合适呢?
热爱医学的小猪
荧光定量PCR内参差多少是可以接受的?
荧光定量PCR是常用的针对mRNA水平的研究方法,可以同时检测多种目的基因的mRNA水平,为文章增加说服力。
我们做的实验方法大致如下:取小鼠淋巴结细胞制成单细胞悬液,分选CD4 T细胞(通过磁珠分选得到,各样本所得细胞总数基本一致,大约在10E6左右),利用经典的Trizol方法提取RNA,其质量在各样本间基本一致且符合要求,选取2ug RNA,用40ul反转录体系(Takara反转录试剂盒),37度10分钟,85度5秒,12度结束反转录。得到的cDNA加一倍的稀释液用于荧光定量PCR检测,荧光定量的体系采用SYBR作为荧光物质。
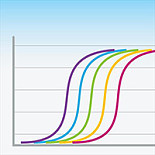
然而荧光定量PCR历来以敏感著称,在实验中经常会遇到一些问题。我们遇到的问题是内参表达(内参的Ct值)在各样本间表达不均一,请看下图(这是不同样本内参的相对表达量,可以看出内参的表达相差在10倍左右
分享
2 个回答
seuzsl
有帮助
理论上讲不同样本内参Ct值的差异并不影响结果解释,因为对于同一个样本而言,目的基因ct-内参ct应该是一个常数,而在提取RNA时,取样量(即,细胞数)存在差异会导致得到的RNA总量有差异,即便通过细胞计数取了等量的细胞,提取时RNA的得率也不同,即便取了相同质量的RNA进行逆转录,不同样本间降解程度、其它rna表达水平都可能会导致内参ct存在差异(当然这种差异不应该很大),这就是为啥一定要做内参,并且每次扩增样本时都要做的原因。
通过你的结果,有两种可能,一是内参不合适,考虑换内参;二是你的结果就是真实的结果
毛线鸡公山
有帮助
内参基因/管家基因有varibility的,有些时候我的内参差值也会超过3,但是大多数我可以控制在2以内,原则上要在0.5之内,不过很难。。
HPRT我没有用过,据说不太好。。我用的是GAPDH和BETA-ACTIN。。
至于WB嘛,其实也很难说,因为我用BCA法measure the concentration of protein,loading to 30ug protein,然后有一个样本的内参照条带很淡,比其他的所有样本都要淡,那个样本浓度我测过3次,没有出错(3次我都做了标曲)。嘿嘿,也是找不到原因,诡异的事很多滴~也不见得WB要比PCR好吧~~
暂时只能说那么多了,貌似不能解决你的问题呀~~
相关产品推荐
相关问答
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序