MACSQuant Tyto 分选有效提高造血干细胞移植与基因修饰
美天旎
由于基因编辑技术的日益演进,不仅细胞核内基因编辑可修复 DNA 缺陷帮助治疗遗传疾病 (如脊髓性肌萎缩症),也可导入特定基因增强细胞功能消灭恶性肿瘤(如 CART 治疗 B 细胞淋巴瘤)。今年 7 月 Nature 发表的线粒体基因编辑工具更是横空出世,这对于 mtDNA 突变引起的母系遗传 Leigh 综合征、线粒体肌病等线粒体遗传疾病的研究、治疗和治愈带来了希望。
如今,结合基因治疗的造血干细胞移植,已有多项重大研究与临床应用正如火如荼地展开。如 2019 年欧盟批准基因治疗与干细胞治疗双剑合璧,来修复地中海贫血患者的造血干细胞缺陷。

Bluebird bio 宣布欧盟有条件授权营销 ZYNTEGLO™(自体CD34+ 细胞 encoding βA-T87Q-globin gene)的基因治疗,针对 12 岁及以上患有输注依赖性β-地中海贫血的患者进行治疗。
2019 年,中国北京大学-清华大学生命科学联合中心的邓宏魁教授研究团队, 建立基于 CRISPR 在人成体造血干细胞上进行 CCR5 基因编辑的技术体系,实现了经基因编辑后的成体造血干细胞在人体内长期稳定的造血系统重建。邓宏魁教授由此入选Nature 2019 年度影响世界的十大科学人物。
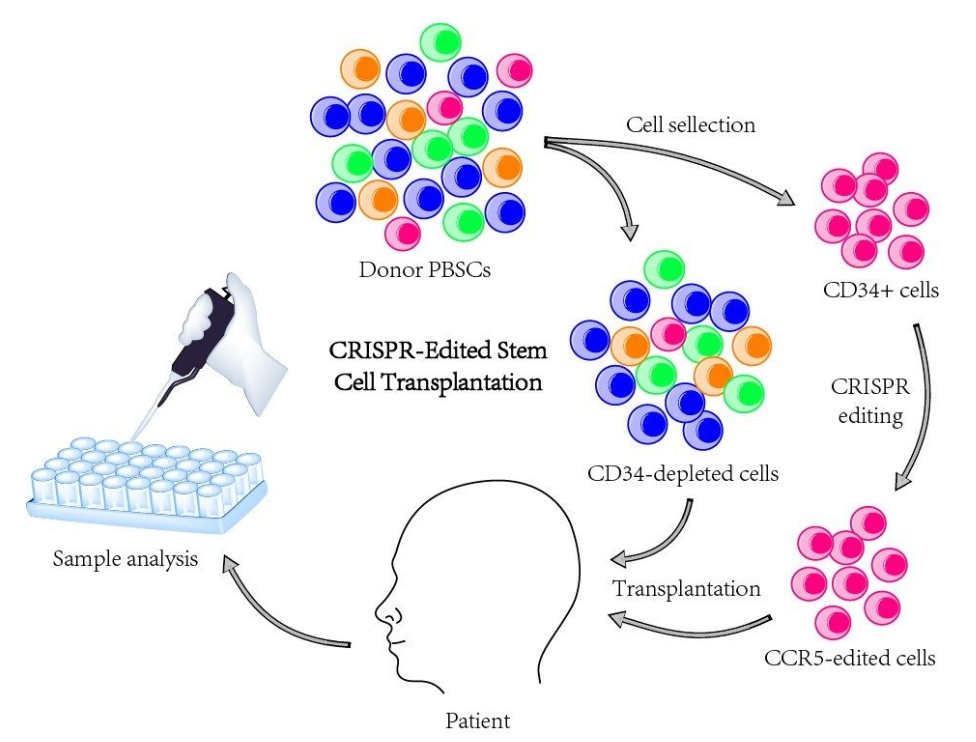
利用 CRISPR-Cas9 在造血干细胞和祖细胞(HSPCs)中编辑 CCR5 基因,并成功移植到一名同时患有 HIV 和急性淋巴白血病的27 岁男性患者。基因编辑后的造血干细胞移植治疗使患者的急性淋巴白血病得到完全缓解,携带 CCR5 突变的供体细胞能够在受体体内长期存活已达 19 个月,初步探索了该方法的可行性和安全性。
一、造血干细胞(HSC)移植
造血干细胞(HSC)移植被多次证明用于治疗多种血液恶性疾病或免疫重建具有良好的作用。HSC 介导的血液病基因治疗通常采用单标记物纯化的 CD34+ 细胞。然而,CD34+ 细胞是一种异质混合的 HSPCs;只有极少数真正的 HSC,具有长期植入的潜力。而且真正的 HSCs 数量在个体间存在着差异性,因此若要达到移植有效且一致性,需移植大量 CD34+ 细胞( 2- 5×10^6 CD34+ cells/kg)。
这导致过度使用昂贵的试剂(如慢病毒载体或核酸酶)进行基因转导,用以可靠地靶向 HSC。此外,临床前和临床研究中,基因修饰的效率与修饰细胞的体内植入并不明显正相关,这些主要障碍极大地限制了这种非常有前途的技术作为一种潜在的治疗方法的广泛可用性。
HSC 基因治疗和移植将受益于分离、靶向和修饰 HSC 富集亚群的能力,该亚群可提供短期造血/免疫重建和长期多系分化植入。因此,一个确定的靶点(标记物)的可用性可以同时克服目前存在的所有限制:
-
减少所需的修饰试剂 (如病毒)的数量;
-
使 HSC 的基因修饰更加可靠;
-
提高体内移植成功的可预测性。
在过去的四十年里,大量的细胞表面标记物被用来鉴定和纯化人 HSC。基于此,各种各样的 HSC 富集策略来进行基因治疗亦被提出, 包括 CD34+CD38low/–,CD34+CD133+ 或 CD34+CD90+ HSPC 亚群的富集纯化。
位于美国西雅图 Fred Hutchinson 癌症研究中心,Dr. Hans-Peter Kiem 团队于 2020 年 7 月 Mol Ther Methods Clin Dev 期刊上在线发表了使用美天旎 MACSQuant® Tyto® 细胞分选仪(MQ Tyto)富集纯化 CD34+CD90+ HSPC 亚群可靶向目的细胞族群、增加慢病毒基因转导效率,更重要的是可提升長期體內植入功能。
二、CD34+CD90+ 细胞
是 HSC 基因治疗最明确的靶点
过去研究中,Dr. Hans-Peter Kiem 团队已在临床前非人类灵长动物的干细胞移植和基因治疗模型中,证明 CD34+CD90+ HSPC亚群驱动的多系分化长期植入和骨髓重建。
此次研究,团队建立了临床级细胞富集分选与基因转导流程,并同时比较了传统液滴式细胞分选(FACS)与美天旎基于微芯片技术的 MQ Tyto 细胞分选(Tyto)后细胞的表型 (phenotyping)、基因转导率(GFP expression & vector copy number)、干细胞干性维持(CFC assays)与小鼠模型体内植入 (mouse transplant)。
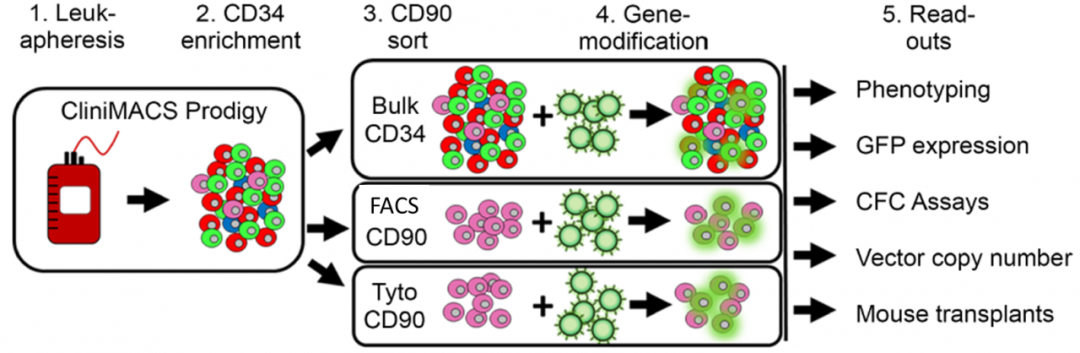
实验流程与 CD34+CD90+ 细胞评估
1. MQ Tyto 细胞分选后,CD34+CD90+ HSPC 纯度可自 16.3% 提升至 77.5%。产率达 49.9% 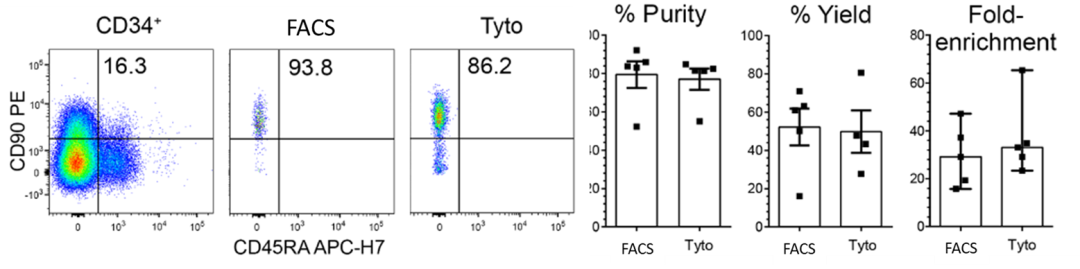
CD34+CD90+纯度与产率比较
2. 经 MQ Tyto 分选后的细胞,慢病毒基因转导率自 16% (Bulk CD34+)提升至 38.1% (Tyto sort)。经由集落形成细胞分析( CFC assay),同时证明 MQ Tyto 分选后的 CD34+CD90+ HSPC 维持良好的造血干细胞干性。
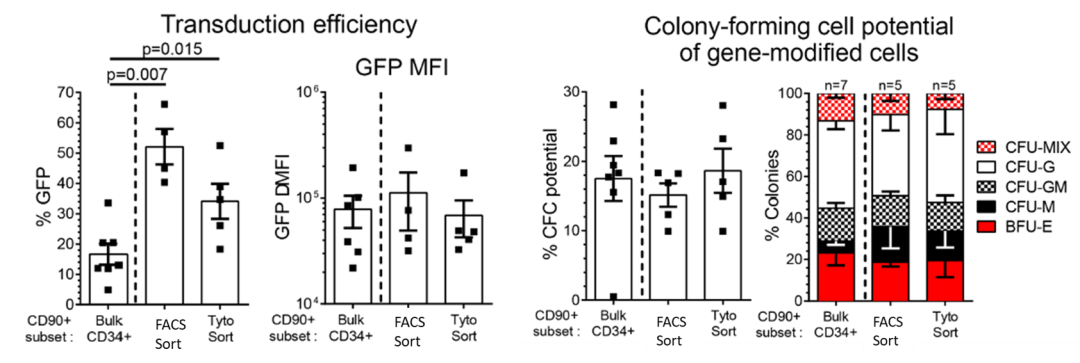
CD34+CD90+ 基因转导率与干细胞干性比较
3. 经 MQ Tyto 分选后的细胞移植小鼠模型,CD34+CD90+ 细胞嵌合物在小鼠外周血与组织中的存活周期可高达 20 周以上,并转移至骨髓、脾脏与胸腺组织中进行重建。
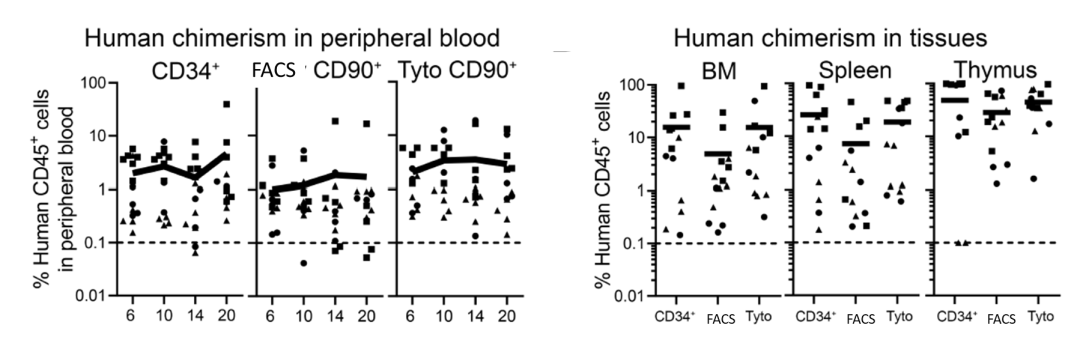
CD34+CD90+ 细胞移植在小鼠模型上的存货周期与组织分布
分离富含 HSC 的 CD34+CD90+HSPC 可提高目前临床 HSC 基因治疗的靶向效率。此篇研究提供了结合基因治疗的造血干细胞移植的细胞分选应用策略, 靶向目的细胞族群、增加慢病毒基因转导效率,更重要的是可提升長期體內植入功能;最终达成基因与细胞治疗目的,终结疾病。
参考文献:
Purification of Human CD34 + CD90 + HSCs Reduces Target Cell Population and Improves Lentiviral Transduction for Gene Therapy. Mol Ther Methods Clin Dev . 2020 Jul 15;18:679-691. doi: 10.1016/j.omtm.2020.07.010. eCollection 2020 Sep 11.